Введение
Типичную форму гипоадренокортицизма (болезнь Аддисона) обычно диагностируют легко, ее классические симптомы и клинико-патологические проявления очевидны и хорошо согласуются с анамнезом и данными обследования. Поэтому может показаться странным, зачем гастроэнтерологу при проведении обследования включать это заболевание в список дифференциальных диагнозов. Однако при атипичном гипоадренокортицизме, особенно спонтанном, клиническая картина может быть неспецифичной.
Возможны хронические желудочно-кишечные симптомы различной интенсивности, которые могут быть вызваны или усугублены стрессом и часто хорошо купируются гидратацией и симптоматическим лечением. Таким образом, гипоадренокортицизм, особенно его атипичная форма, может имитировать первичные желудочно-кишечные заболевания и должен входить в список дифференциальной диагностики у собак с неясными и неспецифическими желудочно-кишечными симптомами.
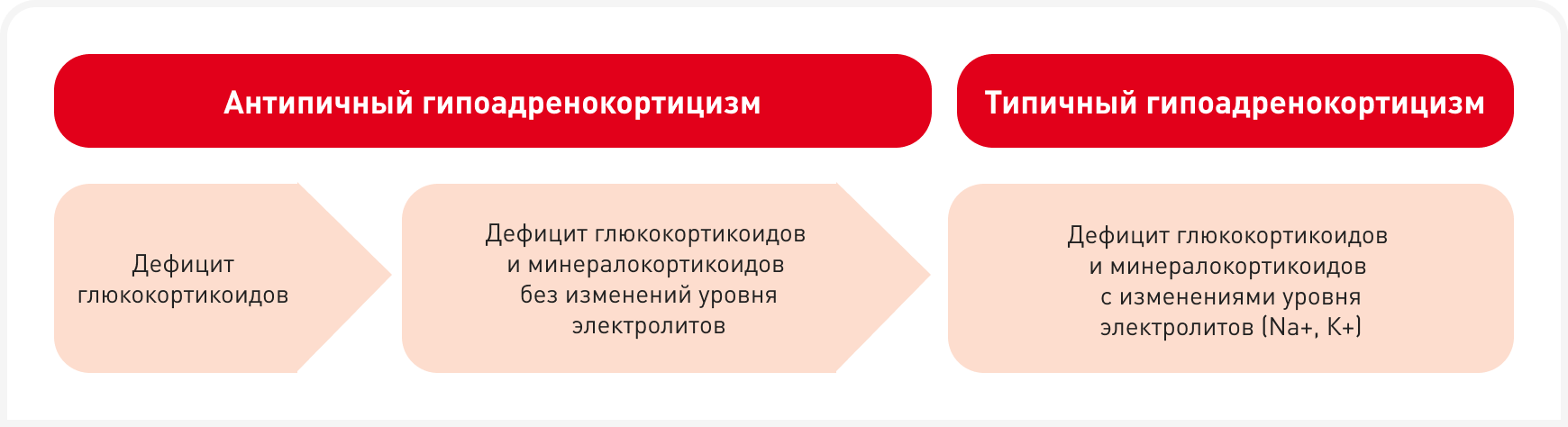
Гипоадренокортицизм, или болезнь Аддисона, развивается, когда кора надпочечников теряет способность вырабатывать и высвобождать достаточное количество эндогенных глюкокортикоидов и — особенно в типичных случаях — также минералокортикоидов (Рисунок 1) (1).
В отличие от типичного гипоадренокортицизма с характерными клиническими и клинико-патологическими особенностями, вызванными одновременным дефицитом глюкокортикоидов и минералокортикоидов, атипичный гипоадренокортицизм у собак диагностировать сложнее, не только потому что эта форма недостаточности надпочечников встречается реже, но и вследствие ее более слабозаметных проявлений и неспецифичной клинической картины (1, 2).
Атипичный гипоадренокортицизм может трансформироваться в типичный, поэтому при наблюдении животных в динамике следует активно искать соответствующие симптомы (2). У собак с обезвоживанием и гиповолемическим шоком (аддисонический криз; типичное проявление клинической декомпенсации заболевания) при первичном осмотре прогрессирование заболевания от начала дефицита глюкокортикоидов можно оценить только по данным анамнеза, поскольку оно развивается медленно и малозаметно. Однако в типичных случаях гипоадренокортицизма это прогрессирование доказать трудно.
Породная предрасположенность описана для стандартных пуделей, португальских водяных собак, новошотландских ретриверов, мягкошерстных пшеничных терьеров и бородатых колли, но обе формы заболевания могут поражать собак любых пород и возрастов (2–5). По сравнению с типичными случаями, собаки с атипичным гипоадренокортицизмом, как правило, старше.
Этиология Гипоадренокортицизм может развиваться при любых состояниях, сопровождающихся снижением выработки и высвобождения гормонов из коры надпочечников. Чаще всего оно вызвано иммуноопосредованным процессом, уменьшающим функциональную массу гормонопродуцирующей коры надпочечников, особенно среднего и внутреннего слоев, продуцирующих глюкокортикоиды (zona fasciculata) (5–7).
Другие, менее распространенные или редкие причины первичного гипоадренокортицизма включают гранулематозы (например, грибковые), поражения сосудов (например, кровоизлияние, ишемия), отложения амилоида (особенно у пород, предрасположенных к развитию амилоидоза), некроз, метастазы опухолей (8–10). Вторичный (центральный) гипоадренокортицизм может развиться при состояниях, нарушающих выработку и высвобождение гипоталамического кортикотропин-рилизинг-гормона (КРГ) и/или адренокортикотропного гормона гипофиза (АКТГ), в том числе при воспалении, инфекции, травме, опухолях (1, 11).
При типичной форме гипоадренокортицизма некомпенсированный дефицит глюкокортикоидов и минералокортикоидов приводит к характерным сдвигам состава электролитов в плазме (гиперкалиемия, гипонатриемия) (1). Напротив, при атипичной форме наблюдается дефицит либо только глюкокортикоидов, либо всех кортикостероидов (глюкокортикоидов и минералокортикоидов) без электролитных сдвигов, поскольку действуют независимые от альдостерона компенсаторные механизмы (например, почечная компенсация) (1, 2).
Учитывая разнообразие влияний эндогенных глюкокортикоидов на организм (Рисунок 2), в том числе на функционирование сердца и желудочно-кишечного тракта (12, 13), клинические проявления у собак при атипичном гипоадренокортицизме обычно неспецифические, неопределенные, нарастающие и ослабевающие, такие как снижение активности (например, во время соревнований по аджилити), вялость, слабость, отсутствие аппетита, потеря веса или худощавость (Рисунок 3), рвота (в том числе с кровью) или регургитация, диарея (в том числе геморрагическая), боли в животе, недержание мочи (1, 2, 13, 14).
Лабораторная диагностика
Минимальный объем обследования должен включать развернутый анализ крови, биохимическое исследование сыворотки, анализ мочи (с оценкой мочевого осадка и, при необходимости, бактериальным посевом с определением чувствительности флоры к противомикробным препаратам, а также с определением соотношения белка и креатинина в моче). При атипичном гипоадренокортицизме у собак изменения обычно малозаметные и неспецифические.
Часто развивается легкая нерегенеративная анемия, поскольку кортизол увеличивает эритропоэз и подавляет обновление эритроцитов, но тонким намеком на диагноз может стать отсутствие ожидаемой стрессовой лейкограммы (или даже противоположное изменение количества отдельных типов клеток, часто называемое обратной стрессовой лейкограммой), которое, однако, легко можно не заметить, если не оценивать специально (Блок 1).
Учитывая противоположно направленное влияние глюкокортикоидов на количество нейтрофилов и лимфоцитов, гипоадренокортицизм можно заподозрить при соотношении нейтрофилов к лимфоцитам ≤ 2,3 (15).
Могут развиться гипогликемия (или концентрация глюкозы в крови по нижней границе нормы), гипоальбуминемия, гипохолестеринемия, повышение активности печеночных ферментов (по гепатоцеллюлярному типу, т. е. повышение уровня АЛТ больше повышения ЩФ) и легкая или среднетяжелая преренальная азотемия (1).
Однако отличить ее от ренальной азотемии непросто, поскольку гипоадренокортицизм у собак часто сопровождается снижением концентрационной функции почек (удельный вес мочи < 1,030). В лучшем случае некоторые или все эти клинико-патологические данные позволяют заподозрить гипоадренокортицизм или по крайней мере учитывать возможность этого диагноза при дифференциальной диагностике (например, с энтеропатией с потерей белка, хронической гепатопатией), предусматривающей применение более инвазивных диагностических методов, в том числе с применением общей анестезии.
Это важно, поскольку инвазивные вмешательства сопровождаются стрессом и, если гипоадренокортицизм останется нераспознанным, могут спровоцировать у собаки опасную для жизни декомпенсацию. Гиперкалиемия и гипонатриемия, часто выражающиеся снижением отношения натрия к калию (Na/K < 27), характерны для типичной формы гипоадренокортицизма, но отсутствуют при атипичной форме (Блок 2) (4).
В будущем улучшить выявляемость случаев атипичного гипоадренокортицизма могут цифровые медицинские инструменты, в частности алгоритмы оценки результатов нескольких рутинных исследований (16).
Эндокринологическое обследование
При скрининге полезно измерение базальной концентрации кортизола в сыворотке крови (Блок 3). Выявление порогового уровня 2 мкг/дл (55 нмоль/л) позволяет (со 100% чувствительностью и 63–78% специфичностью) исключить гипоадренокортицизм (Блок 4) (17, 18).
Если исходный уровень < 2 мкг/мл, следует провести стимулирующую пробу с АКТГ, чтобы подтвердить либо исключить гипоадренокортицизм (1, 17, 18). В этой пробе уровень кортизола в сыворотке крови < 2 мкг/дл позволяет подтвердить, а уровни > 6 мкг/дл — исключить этот диагноз.
Гипоадренокортицизм у собак диагностируют с помощью стимулирующей пробы с низкой дозой АКТГ (1 мкг/кг косинтропина внутривенно вместо стандартной дозы 5 мкг/кг) (19). Измерив концентрацию эндогенного АКТГ (эАКТГ), можно подтвердить и точнее классифицировать гипоадренокортицизм по происхождению на первичный и вторичный (Блок 5) (1, 15). Первичный гипоадренокортицизм (надпочечникового происхождения) сопровождается нормальной или высокой, а вторичный (центрального происхождения, при поражении гипоталамуса и/или гипофиза) — неопределяемой или низкой концентрацией эАКТГ.
Недавно для диагностики гипоадренокортицизма у собак было предложено использовать соотношение концентраций кортизола и креатинина в моче (UCCR), и низкое соотношение UCCR (≤2 при измерении радиоиммуноанализом или ≤10 при измерении хемилюминесцентным иммуноанализом) позволило с высокими чувствительностью и специфичностью отличать истинный гипоадренокортицизм у собак от имитирующих его заболеваний (20).
Дефицит минералокортикоидов без развития гиперкалиемии и/или гипонатриемии, предположительно компенсируемый преимущественно почечными механизмами, можно выявить по динамике уровня альдостерона в сыворотке крови до и после стимуляции АКТГ (Блок 6).
Проба позволяет дифференцировать атипичный гипоадренокортицизм с изолированным дефицитом глюкокортикоидов от комбинированного дефицита кортикостероидов, но без изменений уровня электролитов (21). При гипоадренокортицизме у собак в профилях гормонов щитовидной железы может повышаться уровень ТТГ в сыворотке крови и иногда снижаться уровень тироксина (Блок 3); эти показатели не свидетельствуют о развитии истинного гипотиреоза и нормализуются в течение недель (до 4 месяцев) после начала лечения гипоадренокортицизма (22).
Диагностическая визуализация
Рентгенография органов грудной клетки и брюшной полости у собак с гипоадренокортицизмом обычно не информативна, если только не проводится для выявления мегаэзофагуса, развившегося вследствие гипоадренокортицизма, но позволяет исключить ряд дифференциальных диагнозов.
Ультразвуковое исследование органов брюшной полости с тщательной оценкой обоих надпочечников часто также не информативно, но иногда диаметр надпочечников уменьшен, что позволяет заподозрить гипоадренокортицизм (Рисунок 4). Ультразвуковое исследование также показано в подозрительных случаях для диагностики или исключения новообразований, инфаркта или кровоизлияния в надпочечники (1).
Клиническое состояние собак с атипичным гипоадренокортицизмом, как правило, стабильное, и их можно лечить амбулаторно. Однако если при осмотре выявлены признаки обезвоживания, требуется по крайней мере кратковременное стационарное лечение с проведением гидратационной заместительной терапии (с использованием сбалансированного раствора электролитов) и дополнительного симптоматического лечения (например, противорвотными и гастропротекторами) по показаниям. Гипогликемию корректируют внутривенным введением глюкозы (раствора декстрозы) с контролем уровня глюкозы в крови.
Препаратами выбора для восполнения эндогенного дефицита глюкокортикоидов считают преднизолон (или преднизон) (1–3). Для активной заместительной глюкокортикоидной терапии при адиссоническом кризе чаще используют глюкокортикоиды с быстрым началом действия (например, дексаметазон, гидрокортизон).
Преднизон или преднизолон первоначально вводят в низкой противовоспалительной дозе (0,3–0,5 мг/кг перорально каждые 12–24 часов) в течение нескольких дней (1, 2). После этой короткой индукционной фазы дозы постепенно снижают до минимально возможного («физиологического») уровня, позволяющего корректировать эндогенный дефицит глюкокортикоидов, но не вызывающего явных побочных эффектов, и продолжают вводить эту дозу в качестве поддерживающей.
Для подбора оптимальной дозы для конкретной собаки потребуется некоторое время (и терпение владельца); обычно в зависимости от размера и возраста собаки доза составляет от 0,05 до 0,2 мг/кг в сутки перорально (Блок 7). В зависимости от характера и темперамента собаки можно рассмотреть кратковременное увеличение поддерживающей дозы преднизолона в периоды ожидаемого стресса (1, 2).
Заместительная терапия минералокортикоидами показана в типичных случаях гипоадренокортицизма (т. е. у собак с электролитными изменениями, отражающими сопутствующий дефицит минералокортикоидов), но у собак с атипичным гипоадренокортицизмом ее следует проводить с осторожностью, в зависимости от эндогенного минералокортикоидного статуса.
Если концентрация альдостерона в сыворотке крови низкая или неопределимая, следует тщательно контролировать уровень электролитов в сыворотке крови. В качестве альтернативы можно рассмотреть прием низких доз минералокортикоидов (дезоксикортикостерона пивалата в начальной дозе 1,5 мг/кг п/к каждые 25–28 дней) (23). Оно может, по крайней мере теоретически, ослабить механизмы компенсации (измеряемого) дефицита минералокортикоидов, поэтому при длительной заместительной терапии минералокортикоидами также требуется тщательно контролировать состояние пациента (уровень электролитов в сыворотке крови, системное артериальное давление) и наблюдать за потенциально возможными побочными эффектами (24).
Собакам с атипичным гипоадренокортицизмом при нормальной исходной и/или стимулированной АКТГ концентрации альдостерона в сыворотке крови требуется только заместительная терапия глюкокортикоидами, но у этих собак следует регулярно контролировать уровень электролитов в сыворотке крови.
Побочные эффекты глюкокортикоидов (например, полидипсия/полиурия, полифагия, увеличение веса, потеря мышечной массы, одышка, изменения кожи и шерсти, изменения поведения) возможны даже при очень низких дозах преднизолона, и для их купирования требуется снизить дозу примерно на 10–15% (Блок 7). У некоторых собак в качестве альтернативы глюкокортикоидам может использоваться гидрокортизон, но этот вопрос требует дальнейшего изучения. Вялость, слабость, гипорексия или анорексия, рвота и диарея служат признаками того, что заместительная терапия глюкокортикоидами неоптимальна, и требуется увеличение дозы примерно на 50% (1–3).
Собак с атипичным гипоадренокортицизмом, получающих заместительную терапию минералокортикоидами, следует вначале обследовать каждые 2–4 недели (обычно спустя 10–14 дней и повторно через 25–28 дней после начала приема дезоксикортикостерона пивалата) (23). Если концентрации электролитов (натрия и калия) в сыворотке крови находятся в пределах целевых диапазонов, системное артериальное давление в норме, а дозу дезоксикортикостерона в последнее время не корректировали, рекомендуется продолжать мониторинг лечения каждые 1–3 месяца (в зависимости от того, может ли владелец вводить минералокортикоиды собаке в домашних условиях), а при хорошо контролируемом состоянии — каждые 3–6 месяцев (за исключением случаев, когда дезоксикортикостерон необходимо вводить ежемесячно в ветеринарной клинике).
При гипокалиемии, гипернатриемии или системной гипертонии (систолическое артериальное давление > 140 мм рт. ст.) требуется снижение дозы дезоксикортикостерона пивалата примерно на 10–20% или по крайней мере временная отмена препарата (23). У собак с гипоадренокортицизмом необходимо тщательно оценивать все потенциальные побочные эффекты лечения. Полиурию и полидипсию обычно считают побочным эффектом преднизолона, но они также могут отражать передозировку минералокортикоидов (т. е. дезоксикортикостерона) (1, 23).
Краткая справка
Терминология

Этиология
Патофизиология
Выявление гипоадренокортицизма — «великого притворщика»
Клинические проявления
.png)

.png)
.png)
.png)
.png)
.png)
.png)
.png)
Лечение атипичного гипоадренокортицизма
Начало лечения
.png)
Мониторинг лечения
.png)
Прогноз при гипоадренокортицизме
При адекватном приеме глюкокортикоидов и, по показаниям или по желанию, добавок с минералокортикоидами и последующих регулярных осмотрах долгосрочный прогноз при атипичном гипоадренокортицизме обычно весьма благоприятный (Рисунок 5) (1, 2, 25).
При долгосрочном лечении собак с атипичным гипоадренокортицизмом, получающих монотерапию глюкокортикоидами, важно отслеживать прогрессирование типичного гипоадренокортицизма (т. е. развития гиперкалиемии и/или гипонатриемии) (2, 21). Автор рекомендует в этих случаях измерять уровень электролитов в сыворотке крови каждые 3–6 месяцев, но в настоящее время не предложено рекомендаций по частоте мониторинга или началу назначения минералокортикоидных добавок у собак с дефицитом альдостерона без каких-либо изменений уровня электролитов.
.png)
Заключение
Когда на фоне лечения состояние и качество жизни животного быстро улучшаются, владельцы нередко вспоминают малозаметные клинические проявления медленно разивавшегося гипоадренокортицизма. Собаки с этим заболеванием нуждаются в пожизненном лечении, и часто считается, что это приводит к укреплению связи животного и владельца, но иногда владельцы опасаются развития адиссонического криза и отказываются оставлять собаку без наблюдения врача. Однако большинство владельцев быстро осваивают навыки домашнего ухода за собакой, страдающей любой из форм спонтанного гипоадренокортицизма, и знают или быстро учатся тому, за какими показателями нужно наблюдать, чтобы вовремя выявить изменения, требующие обращения к ветеринарному врачу.
-
1.Kalenyak K, Heilmann RM. Canine hypoadrenocorticism – an update on pathogenesis, diagnosis and treatment. Tierarztl Prax. Ausg. K. Kleintiere Heimtiere 2018;46(3):163-175.
-
2.Thompson AL, Scott-Moncrieff JC, Anderson JD. Comparison of classic hypoadrenocorticism with glucocorticoid-deficient hypoadrenocorticism in dogs: 46 cases (1985-2005). J. Am. Vet. Med. Assoc. 2007;230:1190-1194.
-
3.Schofield I, Woolhead V, Johnson A, et al. Hypoadrenocorticism in dogs under UK primary veterinary care: frequency, clinical approaches and risk factors. J. Small Anim. Pract. 2021;62(5):343-350.
-
4.Gershony LC, Belanger JM, Hytönen MK, et al. Genetic characterization of Addison’s disease in Bearded Collies. BMC Genomics 2020;21(1):833.
-
5.Treeful AE, Rendahl AK, Friedenberg SG. DLA class II haplotypes show sex-specific associations with primary hypoadrenocorticism in Standard Poodle dogs. Immunogenetics 2019;71(5-6):373-382.
-
6.Boag AM, Short A, Kennedy LJ, et al. Polymorphisms in the CTLA4 promotor sequence are associated with canine hypoadrenocorticism. Canine Med. Genet. 2020;7:2.
-
7.Boag AM, Christie MR, McLaughlin KA, et al. Autoantibodies against cytochrome P450 side-chain cleavage enzyme in dogs (Canis lupus familiaris) affected with hypoadrenocorticism (Addison’s disease). PLoS One 2015;10(11):e0143458.
-
8.Labelle P, DeCock HEV. Metastatic tumors to the adrenal glands in domestic animals. Vet. Pathol. 2005;42:52-58.
-
9.Buckley ME, Chapman PS, Walsh A. Glucocorticoid-deficient hypoadrenocorticism secondary to intravascular lymphoma in the adrenal glands of a dog. Aust. Vet. J. 2017;95(3):64-67.
-
10.Lee N, Choi J, Yoon J. Presumptive nontraumatic adrenal hemorrhage preceding hypoadrenocorticism in a dog. J. Vet. Intern. Med. 2022;DOI: 10.1111/jvim.16531.
-
11.Polledo L, Oliveira M, Adamany J, et al. Hypophysitis, panhypopituitarism, and hypothalamitis in a Scottish Terrier dog. J. Vet. Intern. Med. 2017;31(5):1527-1532.
-
12.Gunasekaran T, Sanders RA. Ventricular systolic dysfunction in dogs diagnosed with hypoadrenocorticism. J. Vet. Cardiol. 2022;41:231-235.
-
13.Hauck C, Schmitz SS, Burgener IA, et al. Prevalence and characterization of hypoadrenocorticism in dogs with signs of chronic gastrointestinal disease: a multicenter study. J. Vet. Intern. Med. 2020;34(4):1399-1405.
-
14.Gallego AF, Gow AG, Boag AM. Evaluation of resting cortisol concentration testing in dogs with chronic gastrointestinal signs. J. Vet. Intern. Med. 2022;36(2):525-531.
-
15.Zeugswetter FK, Schwendenwein I. Diagnostic efficacy of the leukogram and the chemiluminometric ACTH measurement to diagnose canine hypoadrenocorticism. Tierarztl. Prax. Ausg. K. Kleintiere Heimtiere 2014;42(2):223-230.
-
16.Reagan KL, Reagan BA, Gilor C. Machine learning algorithm as a diagnostic tool for hypoadrenocorticism in dogs. Domest. Anim. Endocrinol. 2020;72:106396.
-
17.Lennon EM, Boyle TE, Hutchins RG, et al. Use of basal serum or plasma cortisol concentrations to rule out a diagnosis of hypoadrenocorticism in dogs: 123 cases (2000-2005). J. Am. Vet. Med. Assoc. 2007;231(3):413-416.
-
18.Bovens C, Tennant K, Reeve J, et al. Basal serum cortisol concentration as a screening test for hypoadrenocorticism in dogs. J. Vet. Intern. Med. 2014;28(5):1541-1545.
-
19.Botsford A, Behrend EN, Kemppainen RJ, et al. Low-dose ACTH stimulation testing in dogs suspected of hypoadrenocorticism. J. Vet. Intern. Med. 2018;32(6):1886-1890.
-
20.Moya MV, Refsal KR, Langlois DK. Investigation of the urine cortisol to creatinine ratio for the diagnosis of hypoadrenocorticism in dogs. J. Am. Vet. Med. Assoc. 2022;260(9):1041-1047.
-
21.Baumstark ME, Sieber-Ruckstuhl NS, Müller C, et al. Evaluation of aldosterone concentrations in dogs with hypoadrenocorticism. J. Vet. Intern. Med. 2014;28(1):154-159.
-
22.Reusch CE, Fracassi F, Sieber-Ruckstuhl NS, et al. Altered serum thyrotropin concentrations in dogs with primary hypoadrenocorticism before and during treatment. J. Vet. Intern. Med. 2017;31(6):1643-1648.
-
23.Sieber-Ruckstuhl NS, Reusch CE, Hofer-Inteeworn N, et al. Evaluation of a low-dose desoxycorticosterone pivalate treatment protocol for long-term management of dogs with primary hypoadrenocorticism. J. Vet. Intern. Med. 2019;33(3):1266-1271.
-
24.Casado Diaz JI, Sieber-Ruckstuhl NS, Boretti FS, et al. Evaluation of symmetric dimethylarginine and creatinine in dogs with primary hypoadrenocorticism receiving long-term mineralocorticoid replacement therapy. Vet. Rec. 2022;190(1):e242.
-
25.Hupfeld J, Dölle M, Volk H, et al. Effect of long-term management of hypoadrenocorticism on the quality of life of affected dogs and their owners. Vet. Rec. 2022;8:e1977.




 2076
2076  10 мин
10 мин











