Введение
Грибковые инфекции кожи часто встречаются в практике ветеринарного врача. Стригущий лишай, или дерматофитоз – одна из наиболее распространенных грибковых заболеваний кожи у кошек. Дерматофиты питаются кератином, поэтому поражают кожу и шерстный покров, что клинически проявляется фолликулитом. В отличие от одноклеточных дрожжей, дерматофиты представляют собой сложные грибы, растущие в виде гиф и образующие мицелий. К дерматофитам принадлежит почти 40 видов, относящихся к родам Microsporum (микроспория), Trichophyton (трихофития) и Epidermophyton (эпидермофития). Из всех дерматофитов у кошек наиболее распространена Microsporum canis, для которого кошка служит резервуаром в окружающей среде. Лишай – контагиозная зоонозная болезнь. Его быстрая диагностика и лечение позволят предотвратить распространение возбудителя в окружающей среде, что особенно важно в домах с несколькими животными, питомниках и приютах. Диагностику обычно проводят традиционными методами (включая осмотр с помощью лампы Вуда, трихографию и посев на дерматофиты). ПЦР используют для ускоренной поставки диагноза. Хотя заболевание является самоограничивающимся, для предотвращения распространения инфекции рекомендовано лечение.
Распространенность и предрасположенность
Принято считать, что стригущий лишай – часто встречающийся у кошек микоз, однако его истинная распространенность неизвестна (1). Болезнь наблюдается во всем мире и чаще выявляется у животных, живущих в теплом климате, при групповом содержании, имеющих свободный доступ на улицу, молодых кошек, животных с иммунодефицитом. Чаще, чем у других пород, болезнь встречается у персидских кошек, особенно подкожная форма дерматофитоза - мицетома или псевдомицетома (1, 4).
Патогенез
Большинство грибков являются условно патогенными микроорганизмами и поражают животных с ослабленным иммунитетом. В данном случае это неспецифический иммунный ответ, для которого не требуется предварительной сенсибилизации к антигенам: физический кожный барьер, температура тела, pH кожи, антимикробные пептиды на поверхности кожи. В состав врожденной иммунной системы животных также входят клетки, распознающие на поверхности возбудителя консервативные области (так называемые патоген-ассоциированные молекулярные паттерны, или PAMP) и осуществляющие иммунную атаку. Дерматофиты проникают в поверхностные слои кожи, волосяной стержень/фолликул и когти, быстро инфицируют организм хозяина, обходя при этом механизмы врожденного иммунитета и вырабатывая грибковые протеазы, способствующие проникновению возбудителя в кератин-содержащую ткань (5–7). Артроспоры, выделяемые из кожи, шерсти и когтей инфицированных животных в окружающую среду, составляют инфекционную стадию жизненного цикла. Гифы грибка в инфекционных артроспорах фрагментируются, контактируют с новым хозяином и в течение нескольких часов после контакта вызывают у него развитие инфекции. После контакта с кожей артроспоры образуют зародышевые трубки, проникающие в роговой слой и шерсть (5). Грибковая инфекция чаще возникает у животных с микротравмами кожи (например, царапинами при аллергии, травмами от лезвия машинки при стрижке), эктопаразитами, в участках повышенной влажности кожи (7). Клинические симптомы развиваются через 2–4 недели после инфицирования, но уже в бессимптомном периоде животные контагиозны (8). Инфицированные шерсть и споры остаются жизнеспособными в окружающей среде на протяжении 12–18 месяцев, но повторное заражение вызывают редко (1).
Иммунный ответ организма хозяина на гифы и артроспоры дерматофита, опосредованный нейтрофилами, макрофагами и выделением цитокинов, позволяет инфекции спонтанно разрешиться в течение нескольких недель или месяцев; однако у питомцев с ослабленным иммунитетом инфекция может сохраняться дольше. Причинами затяжной инфекции могут быть: физическое повреждение кожного покрова, хирургическое вмешательство, плохие условия содержания животного, сопутствующие болезни (например, аллергический дерматит, эндокринопатия, новообразование), прием иммуносупрессивных препаратов (например, глюкокортикостероидов, химиотерапевтических препаратов).
Клинические проявления
Как выглядит стригущий лишай у кошек?
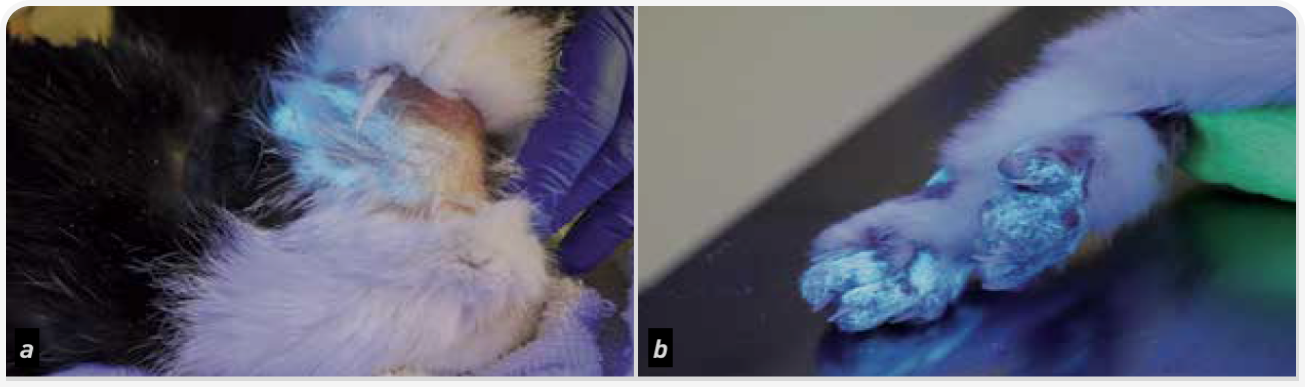
Стригущий лишай у кошек проявляется в виде участков алопеции, сломанных волос, шелушения, корочек и чешуек на коже. Также могут возникать папулы, пустулы, гиперпигментация и деформация когтей. Поражения часто многоочаговые, асимметричные. Зуд, как правило, отсутствует. Наиболее часто наблюдаются воспалительные изменения волосяных фолликулов и кожи. В зависимости от иммунного статуса животного и тяжести течения возможны очаги фолликулита, формирование чешуек, корок, гиперпигментации и других вторичных кожных элементов. При поражении когтей наблюдаются их утолщение, ломкость и деформация. В отдельных случаях болезнь протекает с образованием узелков, язв и свищей в глубоких слоях кожи. Как правило, поражения многоочаговые и асимметричные, зуд отсутствует. Примеры клинических симптомов см. на рисунках 1–3.



Дифференциальный диагноз
Основные дифференциальные диагнозы у кошек с подозрением на лишай – поверхностный фолликулит при инфекциях Staphylococcus spp. и Demodex spp., а также аллергический дерматит и комплекс эозинофильной гранулемы. Реже при диагностике рассматривают психогенную алопецию, анагенное/телогенное облысение, листовидную пузырчатку, атрофическую алопецию, эксфолиативный дерматит при тимоме, кожную лимфому. Узелковые формы заболевания могут напоминать ветеринарному врачу другие оппортунистические бактериальные (например, вызванные Mycobacteria spp., Nocardia spp.) или грибковые (например, феогифомикоз, гиалогифомикоз, зигомикоз) инфекции, новообразования или стерильный узелковый панникулит.
Диагноз
Во многих случаях диагноз лишай устанавливают только через несколько дней или недель, поскольку поражения скрыты в шерсти, или вет.врач ошибочно диагностирует пиодермию и аллергический дерматит. Задержки в диагностике приводят к увеличению контаминации окружающей среды и риску распространения инфекции в популяции животных и людей.

«
При диагностике дерматофитоза важнее всего подтвердить наличие инфекции при появлении клинических признаков и отсутствие инфекции по окончании лечения
При диагностике дерматофитоза важнее всего подтвердить наличие инфекции при появлении клинических симптомов и отсутствие инфекции по окончании лечения (1). В большинстве ветеринарных клиник можно провести базовую диагностику (лампа Вуда, трихография, цитологическое исследование на дерматофиты, посев). Точный диагноз очень важен для принятия решения о том, каких животных следует лечить, изолировать и повторно тестировать. Если тесты отрицательные, питомцев можно вернуть в популяцию без риска распространения дерматофитов. Для надежной диагностики дерматофитоза ветеринарного врача может использовать комбинацию методов.
Анамнез
Владельцы могут предоставить информацию о том, что в контакте с питомцем были животные или люди с подозрительными поражениями кожи. Хотя эта информация повышает подозрение на стригущий лишай, ее недостаточно для окончательной постановки диагноза.
Лампа Вуда
Большинство изолятов M. canis флуоресцируют ярко-зеленым светом, при использовании ультрафиолета, выявляющего таким образом химическую реакцию дерматофита и водорастворимого метаболита птеридина, содержащегося в волосах (1,9) (Рисунок 4). До начала противогрибкового лечения флуоресценцию наблюдают у 91–100% спонтанно инфицированных кошек, после лечения этот показатель может снизиться до 39–53% (1). Помните, что флуоресцировать, приводя к ложноположительному результату, могут и другие объекты (лекарства, бактерии, налет/ корка, мыло, бензин и волокна ткани), но они не будут вызывать классической зеленой окраски. Отсутствие флуоресценции не исключает диагноз стригущий лишай, поэтому осмотра под лампой Вуда может быть недостаточно. В этом случае важно провести ПЦР-тест или посев.
Среда для исследования дерматофитов (DTM)
DTM – специализированные грибковые агары для выращивания дерматофитов; они содержат антибактериальные и противогрибковые средства для предотвращения контаминации, а также феноловый красный – индикатор рН, который окрашивается в красный цвет при росте дерматофитов, выделяющих щелочные метаболиты. Чашки с DTM следует осматривать ежедневно, одновременно оценивая рост колоний и изменения цвета агара. В одном исследовании было показано, что DTM по надежности не уступают диагностическому лабораторному посеву на дерматофиты, если соблюдаются инструкции производителя по хранению и инкубации. Рост колоний оценивают микроскопически с определением морфологии репродуктивных структур грибов (макроконидии и микроконидии) (10). Результат посева на дерматофиты считают отрицательным, если в течение 14 дней не происходит роста (11), хотя при отборе неинфицированных шерстинок, малом размере, неправильном хранении и инкубации образца, а также при чрезмерном росте в материале бактериальных/грибковых загрязнителей возможны ложноотрицательные результаты (1).
Образцы кожи и шерсти собирают выщипыванием, зубной щеткой или липкой лентой. При сборе образцов шерсть выщипывают с краев поражений, выбирая волоски, флуоресцирующие в свете лампы Вуда. В качестве альтернативы ветеринарный врач может использовать стерильную зубную щетку, расчесывая верхнюю часть и края клинически видимых поражений. Если поражения клинически не видны, нужно расчесывать всю шерсть, проведя около двадцати движений в течение двух-трех минут или пока в щетинках не соберется достаточно шерстинок (1, 12). Чаще всего на пораженные участки кожи наклеивают липкую ленту, материал с которой непосредственно переносят на пластину для посева на грибок (13). Как правило, при мониторинге ответа на лечение и микологического излечения предпочтение отдают посеву на дерматофиты. Согласно современным рекомендациям, мониторинг на лишай лучше всего проводить путем оценки поражений кожи, данных осмотра под лампой Вуда и количества колониеобразующих единиц (КОЕ/чашка) при посеве. Реакцию на лечение определяют как снижение количества КОЕ/ чашка, а клиническое излечение определяют как получение двух-трех отрицательных посевов на дерматофиты (1).
ПЦР на дерматофиты
ПЦР – чувствительный и быстрый метод идентификации ДНК дерматофита в коже и шерсти (14, 15). Этот метод не доказывает жизнеспособность дерматофитов, поскольку позволяет только выявить ДНК, поэтому для подтверждения наличия живых микроорганизмов положительный результат ПЦР следует сочетать с посевом на DTM, особенно при отсутствии клинических симптомов у животного. Положительный результат ПЦР на дерматофитоз может свидетельствовать о любом из следующих вариантов: активная инфекция, разрешающаяся инфекция, контаминация шерсти. Отрицательный результат ПЦР на лишай может указывать на отсутствие инфекции или на ошибки при сборе образцов (1). Метод определения дерматофитоза с помощью ПЦР быстрый, доступный и высокочувствительный (т. е. позволяет обнаруживать небольшое количество ДНК в небольшом объеме образца). ПЦР на лишай лучше всего использовать для первоначальной быстрой диагностики, а посев на DTM более надежен для мониторинга ответа на лечение в случаях, когда ПЦР остается положительным (14–18). Отрицательный результат ПЦР у кошек на фоне лечения дерматофитоза позволяет диагностировать излечение от грибка (1).
Цитологическое исследование кожи
Цитологическое исследование отпечатка, прямого и с ацетатной лентой, позволяет при соответствующем окрашивании выявлять нейтрофилы и некоторое количество макрофагов. Иногда у сильно инфицированных дерматофитозом животных выявляют грибковые артроспоры. При тонкоигольной аспирации дермальных узелков, вызванных дерматофитозом, выявляют пиогранулематозное воспаление и иногда грибковые гифы и/или артроспоры.
Дермоскопия
У некоторых ветеринарных дерматологов в арсенале есть специализированный дерматоскоп. Он увеличивает изображение кожи и шерсти и позволяет выявить типичные для дерматофитоза изменения: непрозрачные, слегка изогнутые, сломанные и утолщенные («в форме запятой») шерстинки, а также коричневые или желтые корки на коже (19).
Трихография
При микроскопии флуоресцирующей и/или пораженной шерсти в стержнях пораженных волос выявляют грибковые гифы дерматофитов и скопление артроспор вдоль или внутри стержней (Рисунок 5). Подозрительные волоски выщипывают, а с области алопеции берут соскоб. В одном исследовании частота положительной идентификации дерматофитии при выщипывании шерсти и соскоба кожи достигла 87,5% инфицированных кошек (20).

Посев на грибок и гистопатологическое исследование мацерированной ткани
Дерматофиты редко вызывают глубокие узелковые поражения. Такие поражения, называемые псевдомицетомой или мицетомой, обычно содержат очень мало грибковых элементов, поэтому при гистопатологическом исследовании признаки дерматофитии в ткани, даже при использовании специализированных окрасок, таких как периодическая кислота Шиффа (PAS) или метенаминовое серебро Грокотта (GMS), выявляют не всегда. Если при гистопатологическом исследовании выявляют элементы дерматофитов, вид грибка определяют при помощи посева или ПЦР. Важно помнить, что при псевдомицетоме даже посев ткани может дать ложноотрицательный результат (4, 21).
Лечение и профилактика
Для уменьшения контаминации окружающей среды и распространения дерматофитоза при выявлении у кошки поражений или при положительном результате посева или ПЦР рекомендуют проводить терапию. Лечение дерматофитоза может быть местным и/или системным, животное на время лечения обычно рекомендуется изолировать. Для профилактики наиболее эффективны минимизация предрасполагающих факторов и деконтаминация окружающей среды. Изолируйте инфицированных животных в легко дезинфицируемых помещениях, без контакта с неинфицированными питомцами. В условиях изоляции у кошек легко развивается стресс, что может усугубить течение болезни, поэтому в консенсусных клинических рекомендациях пришли к выводу о снижении сроков изоляции до минимально возможных (1). Время до выздоровления от дерматофитоза зависит от различных факторов (общего состояния здоровья, возраста, стрессовых факторов, соблюдения режима лечения и т. д.). Лечить питомца потребуется от нескольких недель до нескольких месяцев.
Инфицированные дерматофитами шерсть и споры могут вызвать повторное заражение той же кошки и могут распространиться через окружающую среду на других домашних животных и человека (2, 22). Шерстинки, корки и чешуйки из окружающей среды удаляют при помощи частой (не менее двух раз в неделю) уборки пылесосом и его тщательной очистки. Для деконтаминации от дерматофитов окружающей среды эффективны стирка постельного белья, очистка паром, стабилизированная перекись водорода, отбеливатель, энилконазол. Проводить посевы из окружающей среды не рекомендуется, поскольку загрязнение окружающей среды при наличии инфицированных животных неинформативно.
Местная терапия
Местные обработки важны для уменьшения количества выделяемых животным дерматофитов, поскольку обеспечивает физическое удаление инфицированных дерматофитами шерстинок, чешуек и корок, а также фунгицидное действие. Можно использовать: несмываемые ополаскиватели на основе известковой серы (торговое название «Лайм Сульфур») или энилконазола (торговое название «Имаверол»), противогрибковые шампуни с миконазолом/кетоконазолом/климбазолом, местные средства с тербинафином, препараты стабилизированной перекиси водорода. Однако не все из них достаточно эффективны. В клинических ветеринарных руководствах рекомендуется использовать известковую серу, энилконазол или противогрибковый шампунь с миконазолом/хлоргексидином при генерализованном дерматофитозе. При локальном дерматофитозе поражении - клотримазол, миконазол или энилконазол два раза в неделю в сочетании с другими методами терапии (1).
Для местной обработки кожи используют концентрированные ополаскиватели, шампуни, спреи, лосьоны, муссы или кремы/мази. По данным исследований, стрижка шерсти повышает эффективность местного лечения и снижает контаминацию окружающей среды; однако это вмешательство может быть стрессом для питомца и увеличить распространение инфекции через микроповреждения кожи (1). На эффективность местной терапии и выбор наиболее подходящего средства от дерматофитоза влияет множество факторов, включая индивидуальную переносимость конкретного метода лечения, состояние шерсти, соблюдение правил применения владельцем, характеристики поражения кожи, свойства препарата. Преимуществом местной обработки является отсутствие системных побочных эффектов лекарств, поэтому она безопасна для применения практически у всех животных, включая молодых, старых и ослабленных. При дерматофитозе подкожных тканей местную противогрибковую терапию можно проводить в качестве вспомогательной, но не как монотерапию.
Системная терапия
Системная терапия дерматофитоза подавляет распространение грибковой инфекции в шерсти и коже инфицированного животного, снижает риск ее распространения и риск инфицирования других животных и человека. В современных консенсусных рекомендациях предлагается использовать итраконазол или тербинафин, имеющие широкий профиль безопасности и высокую эффективность, менее эффективными считают кетоконазол и флуконазол (1). Гризеофульвин также эффективен для терапии дерматофитоза, но чаще вызывает серьезные побочные реакции. Луфенурон неэффективен, а противогрибковые вакцины, скорее всего, полезны только в качестве вспомогательной терапии (1).
Итраконазол – это триазол с широким спектром активности. Итраконазол считают фунгистатическим в низких дозах и фунгицидным в высоких дозах. Он обладает высокой липофильностью и накапливается в коже и себуме в концентрации, в десять раз превышающей концентрацию в плазме крови. Рекомендуемая доза при дерматофитозе кошек составляет 5–10 мг внутрь каждые 24 ч с кормом. В исследованиях на кошках было показано, что еженедельная пульс-терапия (5 мг/кг внутрь каждые 24 ч, смена режима через неделю) приводит к кумулятивному увеличению концентрации препарата в волосах выше минимальной подавляющей концентрации (МПК) для M. canis (0,1 мкг/мл) в течение 35 дней (23). Повторная пульс-терапия на этом уровне доз в течение пяти недель обеспечила излечение 97,5% инфицированных животных к девяти неделям терапии (24). Побочные эффекты возможны, но по сравнению с другими азолами и триазолами менее вероятны; они включают желудочно-кишечные расстройства, повышение активности ферментов печени и гепатотоксичность
Тербинафин – синтетический аллиламин широкого спектра действия. Он ингибирует мембраносвязанный фермент дерматофитов сквален-эпоксидазу, предотвращая превращение ланостерола в эргостерол. В одном исследовании на кошках после двухнедельного приема тербинафина в дозе 35-40 мг/кг через день терапевтическая концентрация препарата в волосяном фолликуле сохранялась в течение 56 дней (25). Несмотря на высокую концентрацию препарата в шерсти после приема последней дозы, клинические исследования показывают, что наилучшие результаты достигаются при приеме тербинафина в течение как минимум 21 дня подряд (25, 26). Тербинафин обладает хорошей переносимостью, побочные эффекты (например, желудочно-кишечные расстройства, вялость и потеря веса) наблюдаются редко и протекают легко. Возможно повышение уровня печеночных ферментов, но оно редко выходит за референсные пределы, даже при высоких дозах (1).
Прогноз
Прогноз болезни благоприятный, однако в домах с большим количеством животных и значительно увеличенной контаминацией окружающей среды проводить лечение существенно сложнее. Важно выявлять способствующие развитию инфекции причины (например, аллергию, стресс, иммунодефицит и т.д.) и, если болезнь прогрессирует, начинать лечение.
Заключение
Дерматофитоз – широко распространенный поверхностный грибковый дерматоз, высококонтагиозный для кошек и иногда вызывающий заболевание у других животных и человека. Клинические поражения очень разнообразны. Как правило, они являются многоочаговыми и асимметричными. Не стоит лечить кошку самостоятельно. В любом подозрительном случае необходимо обратиться к ветеринарному врачу. Несмотря на самоограничивающийся характер и благоприятный прогноз болезни, показаны как местные обработки, так и системное лечение для снижения рисков распространения. Рекомендации по лечению могут значительно отличаться в зависимости от распространения заболевания (локальная, генерализованная форма), условий содержания, возраста животного, наличия сопутствующих заболеваний и переносимости препаратов. Ветеринар проведет необходимые тесты и подберет терапию индивидуально.
Литература
- Moriello KA, Coyner K, Paterson S, et al. Diagnosis and treatment of dermatophytosis in dogs and cats: Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol 2017;28:266-e268.
- Mancianti F, Nardoni S, Corazza M, et al. Environmental detection of Microsporum canis arthrospores in the households of infected cats and dogs. J Feline Med Surg 2003;5:323-328.
- DeTar LG, Dubrovsky V, Scarlett JM. Descriptive epidemiology and test characteristics of cats diagnosed with Microsporum canis dermatophytosis in a Northwestern US animal shelter. J Feline Med Surg 2019;21:1198-1205.
- Nuttall TJ, German AJ, Holden SL, et al. Successful resolution of dermatophyte mycetoma following terbinafine treatment in two cats. Vet Dermatol 2008;19:405-410.
- Tainwala R, Sharma Y. Pathogenesis of dermatophytoses. Indian J Dermatol 2011;56:259-261.
- Baldo A, Chevigné A, Dumez ME, et al. Inhibition of the keratinolytic subtilisin protease Sub3 from Microsporum canis by its propeptide (proSub3) and evaluation of the capacity of proSub3 to inhibit fungal adherence to feline epidermis. Vet Microbiol 2012;159:479-484.
- Ogawa H, Summerbell RC, Clemons KV, et al. Dermatophytes and host defence in cutaneous mycoses. Med Mycol 1998;36 Suppl 1:166-173.
- Deboer DJ, Moriello KA. Development of an experimental model of Microsporum canis infection in cats. Vet Microbiol 1994;42:289-295.
- Wolf FT, Jones EA, Nathan HA. Fluorescent pigment of Microsporum. Nature 1958;182:475-476.
- Kaufmann R, Blum SE, Elad D, et al. Comparison between point-ofcare dermatophyte test medium and mycology laboratory culture for diagnosis of dermatophytosis in dogs and cats. Vet Dermatol 2016;27:284-e268.
- Stuntebeck R, Moriello KA, Verbrugge M. Evaluation of incubation time for Microsporum canis dermatophyte cultures. J Feline Med Surg 2018;20:997-1000.
- Goldberg HC. "Brush" technique in animals. Finding contact sources of fungus diseases. Arch Dermatol 1965;92:103.
- Sparkes AH, Robinson A, MacKay AD, et al. A study of the efficacy of topical and systemic therapy for the treatment of feline Microsporum canis infection. J Feline Med Surg 2000;2:135-142.
- Cafarchia C, Gasser RB, Figueredo LA, et al. An improved molecular diagnostic assay for canine and feline dermatophytosis. Med Mycol 2013;51:136-143.
- Jacobson LS, McIntyre L, Mykusz J. Comparison of real-time PCR with fungal culture for the diagnosis of Microsporum canis dermatophytosis in shelter cats: a field study. J Feline Med Surg 2018;20:103-107.
- Jacobson LS, McIntyre L, Mykusz J. Assessment of real-time PCR cycle threshold values in Microsporum canis culture-positive and culture-negative cats in an animal shelter: a field study. J Feline Med Surg 2018;20:108-113.
- Dabrowska I, Dworecka-Kaszak B, Brillowska-Dabrowska A. The use of a one-step PCR method for the identification of Microsporum canis and Trichophyton mentagrophytes infection of pets. Acta Biochimica Polonica 2014;61:375-378.
- Moriello KA, Leutenegger CM. Use of a commercial qPCR assay in 52 high risk shelter cats for disease identification of dermatophytosis and mycological cure. Vet Dermatol 2018;29:66-e26.
- Dong C, Angus J, Scarampella F, et al. Evaluation of dermoscopy in the diagnosis of naturally occurring dermatophytosis in cats. Vet Dermatol 2016;27:275-e265.
- Colombo S, Cornegliani L, Beccati M, et al. Comparison of two sampling methods for microscopic examination of hair shafts in feline and canine dermatophytosis. Veterinaria 2010;24:27-33.
- Chang SC, Liao JW, Shyu CL, et al. Dermatophytic pseudomycetomas in four cats. Vet Dermatol 2011;22:181-187.
- Heinrich K, Newbury S, Verbrugge M. Detection of environmental contamination with Microsporum canis arthrospores in exposed homes to and efficacy of the triple cleaning decontamination technique. 2005;16:205-206.
- Vlaminck K, Engelen M. An overview of pharmacokinetic and pharmacodynamic studies in the development of itraconazole for feline Microsporum canis dermatophytosis. In: Hillier A, Foster A, Kwochka K (eds). Advances in Veterinary Dermatology Oxford: Blackwell Publishing, 2005;130-136.
- Puls C, Johnson A, Young K, et al. Efficacy of itraconazole oral solution using an alternating-week pulse therapy regimen for treatment of cats with experimental Microsporum canis infection. J Feline Med Surg 2018;20:869-874.
- Foust AL, Marsella R, Akucewich LH, et al. Evaluation of persistence of terbinafine in the hair of normal cats after 14 days of daily therapy. Vet Dermatol 2007;18:246-251.
- Moriello K, Coyner K, Trimmer A, et al. Treatment of shelter cats with oral terbinafine and concurrent lime sulphur rinses. Vet Dermatol 2013;24:618-620, e149-650.
Эксперт-квиз по диагностике зуда





 11314
11314  12 мин
12 мин





.png)




