Введение
Кишечным микробиомом называют совокупный геном всех микроорганизмов (т. е. бактерий, вирусов, грибов и простейших), населяющих желудочно-кишечный тракт (ЖКТ), причем наиболее многочисленны из его составляющих бактерии. Микробиом можно рассматривать и как компонент иммунной системы, и как метаболическую единицу, поскольку бактерии продуцируют метаболиты, которые оказывают влияние как на ЖКТ, так и на другие органы. Дисбиозом называют изменения микробиома, которые происходят в случае заболевания: снижение разнообразия его состава (например, числа разных видов бактерий), изменение количества бактерий и функциональные изменения (например, нарушение выработки бактериальных метаболитов). Дисбиоз часто возникает на фоне первичного заболевания кишечника и у некоторых пациентов способствует проявлению клинических признаков (1), поэтому его считают дополнительным маркером кишечных заболеваний и учитывают при общем сборе анамнеза и оценке клинической картины. Терапия дисбиоза должна быть направлена на устранение основной патологии, при этом первым выбором лечения служит изменение рациона.
Бактерии производят метаболиты самостоятельно (витамины) либо преобразуют вещества, полученные из пищи (клетчатка, белки, жиры) или синтезированные в организме хозяина (желчные кислоты); таким образом, микробиота оказывает множественное полезное действие на организм хозяина. К важным метаболитам относятся короткоцепочечные жирные кислоты (КЦЖК), индолы и вторичные желчные кислоты; они обладают различными эффектами, включая противовоспалительное действие, регуляцию моторики кишечника, ингибирование кишечных патогенов, улучшение барьерной функции кишечника, увеличение выработки муцина (2). Дисбиоз часто имеет вторичную природу по отношению к различным факторам просвета кишечника (Блок 1), он изменяет функции микробиоты, что впоследствии способствует развитию клинических проявлений (1).
Особый интерес для регуляции микробиоты представляют желчные кислоты (ЖК) кишечника. Коротко говоря, первичные ЖК (холевая и хенодезоксихолевая кислоты) выделяются в тонкий кишечник после приема пищи для облегчения переваривания жиров. До 95% ЖК реабсорбируется в подвздошной кишке и поступает в энтерогепатическую циркуляцию (3), а оставшаяся часть достигает толстого кишечника, где преобразуется бактериями (у собак и кошек – в основном Clostridium hiranonis) во вторичные ЖК (4). Это преобразование имеет важные последствия для здоровья, так как вторичные ЖК, присутствующие в достаточном количестве, оказывают полезное воздействие на разнообразные процессы. Они усиливают сигналы для различных рецепторов во многих органах, уменьшают воспалительные реакции, снижают уровень глюкозы и подавляют кишечные патогены (5).
Существуют различные методы оценки микробиома собак, различающиеся по эффективности.
Хотя многие ветеринарные врачи до сих пор используют этот метод для диагностики дисбиоза, бактериальный посев фекалий не позволяет оценить микробиом, поскольку большинство кишечных бактерий строго анаэробны и для роста им требуются специальные среды (Рисунок 1). Следовательно, в диагностической лаборатории можно культивировать только небольшой процент видов бактерий. В недавнем исследовании различные аликвоты фекалий здоровых собак и собак с хронической диареей были направлены в три ветеринарные референс-лаборатории для оценки дисбиоза (6). Результаты посева в разных лабораториях не совпали, причем дисбиоз чаще диагностировали в группе здоровых собак. Это исследование показало, что бактериальный посев не следует использовать для оценки микробиоты у собак с хронической диареей, за исключением выявления специфических возбудителей, таких как Salmonella spp.
Молекулярные методы, основанные на секвенировании генов 16S рРНК, позволяют получить исчерпывающую информацию о микробном составе образца фекалий и используются в исследовательских целях. Ряд компаний предлагают коммерческие услуги секвенирования для оценки микробиома у отдельных животных, но в настоящее время методы исследования (например, выделение ДНК, праймеры для ПЦР) между этими лабораториями не стандартизированы. Поскольку референтные интервалы для животных не определены, а выдаваемые каждой лабораторией заключения различаются, интерпретация результатов затруднена. Кроме того, часто встречаются межаналитические различия и нет данных об аналитической валидации этих методов, поэтому оценивать микробиом методами секвенирования у отдельных пациентов в настоящее время не рекомендуется.
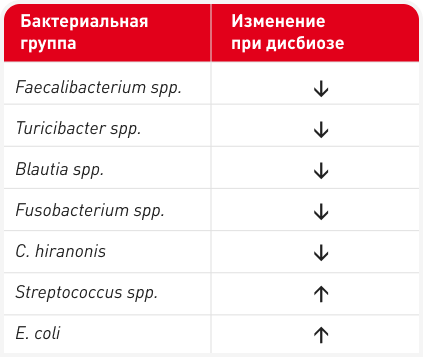
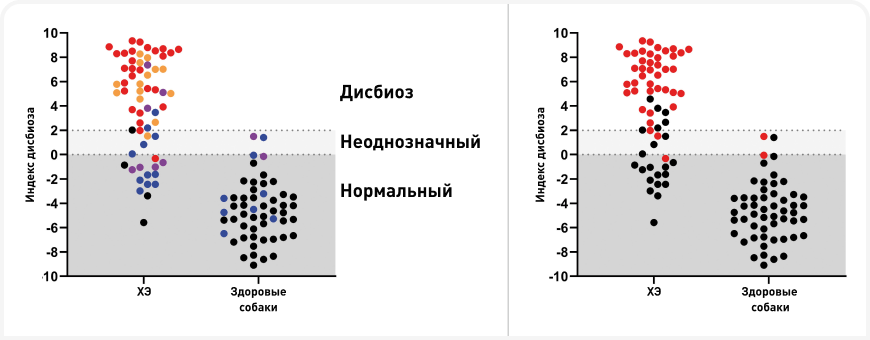
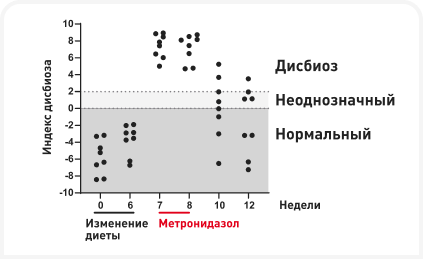
Индекс дисбиоза (ИД) — это количественный тест на основе ПЦР, который в настоящее время доступен в Северной Америке и Европе и используется во многих клинических исследованиях (4, 7), так как это единственный утвержденный метод оценки дисбиоза микробиома у собак. ИД измеряет уровни семи кишечных бактерий (Блок 2), которые обычно изменяются у собак при хронических энтеропатиях (ХЭ) или после применения антибиотиков широкого спектра действия (например, тилозина, метронидазола) (8, 9). Анализ предоставляет референсные интервалы для этих групп бактерий и объединяет данные в одно число, выражающее степень дисбиоза (Рисунок 2); ИД между 0 и 2 указывает на умеренный, а ИД > 2 — на серьезный сдвиг в микробиоте. Чувствительность и специфичность метода показаны в Блоке 3.
ИД также позволяет, оценивая концентрацию C. hiranonis, спрогнозировать способность кишечной микробиоты к преобразованию первичных ЖК во вторичные (4). Нормальное количество вторичных желчных кислот оказывает антимикробное действие и подавляет потенциальные кишечные патогены, такие как C. difficile, C. perfringens и E. coli (10), поэтому снижение уровня C. hiranonis и уменьшение преобразования желчных кислот сильно влияет на развитие дисбиоза и чрезмерное разрастание кишечных патогенов (Рисунок 2) (4, 7, 8, 11).
Выявление у собаки с диареей этих кишечных патогенов, как всех, так и только некоторых из них, свидетельствует не о первичной инфекции, а о чрезмерном росте бактерий вследствие вторичного дисбиоза, развившегося на фоне хронической энтеропатии. Почти у 60% собак с хронической энтеропатией (ХЭ) уровень C. hiranonis снижен, а следовательно, снижен уровень вторичных ЖК (12).
В Таблице 1 приведены механизмы, с помощью которых кишечные бактерии могут способствовать развитию заболеваний, хотя заболевания у отдельных животных при этом будут различными, в зависимости от локализации и тяжести поражения кишечника. Микробиота контактирует со слоем слизи на стенке кишечника, иммунной системой и субстратами в просвете кишечника, и изменения в одном или нескольких из этих компонентов влияют на состав микробиоты, поэтому дисбиоз часто оказывается ранним маркером нарушений среды в кишечнике, сопутствующих различным заболеваниям (Рисунок 3).
Дисбиоз, ограниченный в основном просветом кишечника, часто развивается у пациентов с экзокринной недостаточностью поджелудочной железы (ЭНПЖ) (13), после лечения антибиотиками широкого спектра (8, 9) или у молодых животных из-за незрелости иммунной системы. Хронические энтеропатии сопровождаются воспалением и разрушением слоя слизи и структуры слизистой, что повышает содержание кислорода и количество аэробных бактерий (E. coli) и понижает количество нормальной анаэробной флоры на поверхности слизистой. Развивающаяся при ХЭ утрата структуры слизистой приводит к исчезновению в ней молекул-переносчиков углеводов, аминокислот, жирных и желчных кислот, что ухудшает всасывание этих веществ (14). Увеличение количества этих субстратов в просвете органов ЖКТ может напрямую приводить к развитию осмотической или секреторной диареи, а также к избыточному росту бактерий.
Так как дисбиоз обычно развивается вследствие изменения среды в кишечнике при кишечных заболеваниях и/или изменении факторов окружающей среды, его следует рассматривать в совокупности с анамнезом приема лекарств и клинической картиной. Результаты ИД следует оценивать наряду с определением содержания отдельных бактериальных таксонов, особенно C. hiranonis, поскольку снижение их уровня играет основную роль в нарушении микробиома. ИД выше 2 с высокой специфичностью указывает на дисбиоз, в то время как при ИД менее 2 выводы о сдвигах в микробиоме фекалий неоднозначны. У некоторых собак с ХЭ возможен ИД<0, но некоторые бактериальные таксоны выходят за пределы референсных интервалов, и это представляет собой незначительную форму дисбиоза. В целом, если ИД выходит за пределы нормы, это указывает на заболевание кишечника, поэтому для исключения ХЭ необходимо обследование животного.
Обратите внимание, что на ИД могут влиять некоторые препараты. Например, омепразол может вызвать его временное повышение, которое при нормальном уровне C. hiranonis через 1-2 недели после окончания терапии нормализуется. Антибиотики широкого спектра (например, метронидазол и тилозин) могут приводить к развитию тяжелого фекального дисбиоза (Рисунок 4), но и в этом случае микробиота у большинства собак обычно нормализуется в течение 2-4 недель после окончания терапии, хотя у некоторых особей дисбиоз и пониженное количество C. hiranonis могут сохраняться на протяжении нескольких месяцев (8, 11).
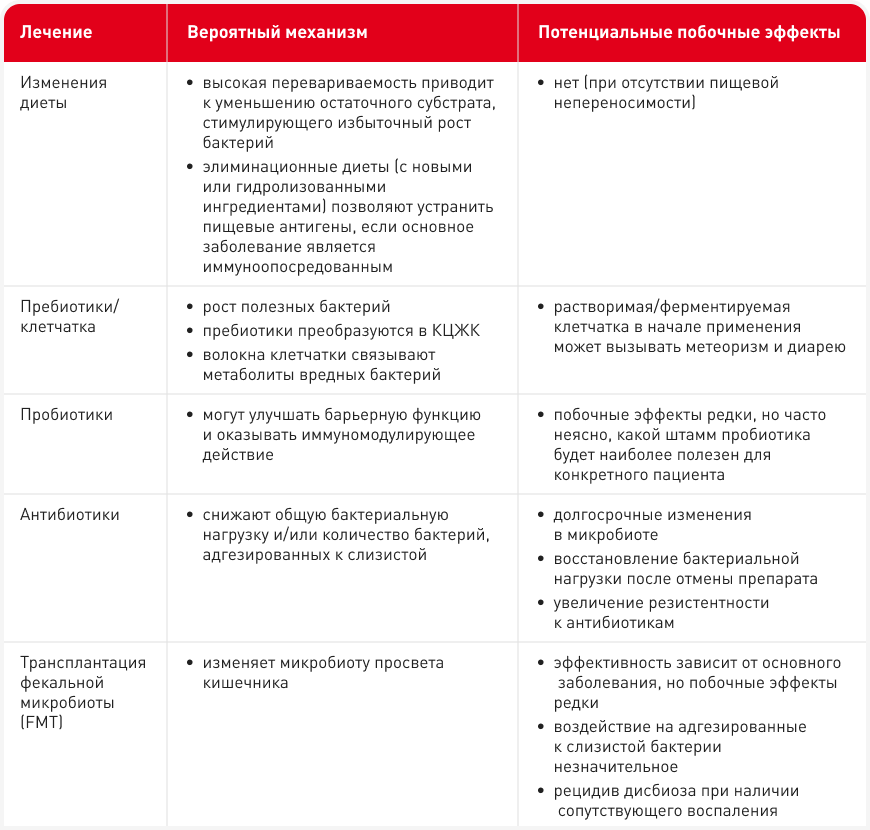
Дисбиоз часто оказывается не единственной составляющей заболевания кишечника, поэтому для его лечения обычно необходима мультимодальная терапия, направленная на устранение основной причины. В некоторых случаях, например у животных с ЭНПЖ, к клиническому улучшению приводит назначение ферментов поджелудочной железы, и кишечный микробиом часто нормализуется через несколько недель после начала терапии (13), но при ХЭ маркеров, позволяющих выбрать более эффективное для конкретного пациента лечение, не существует, поэтому часто требуется поэтапное лечение (16). Методы лечения дисбиоза включают в себя изменение рациона, применение пре- и пробиотиков и антимикробных препаратов, а также трансплантацию фекальной микробиоты (FMT), причем каждый из них воздействует на различные механизмы (Таблица 2); зачастую наиболее эффективна комбинация нескольких методов.
Лечение пациентов в стабильном состоянии всегда следует начинать с изменения диеты. В ряде исследований было показано, что в 50-70% случаев ХЭ у собак есть ответ на изменение рациона (16). Чаще всего для лечения используют легкоусвояемые диеты, содержащие гидролизованные или новые белки. Большинство таких диет гипоаллергенны и уменьшают количество непереваренных остатков пищи в просвете ЖКТ, снижая риск избыточного роста бактерий. В большинстве случаев пищевой энтеропатии для достижения клинической ремиссии достаточно только изменения диеты – в течение нескольких месяцев это приводит к постепенному уменьшению воспаления в кишечнике и дисбиоза (10, 17).
Традиционно для лечения ХЭ рекомендовали антибиотики, такие как тилозин или метронидазол, но сейчас их применение в качестве препаратов первой линии вызывает сомнения (16). Хотя они могут привести улучшению клинического состояния, предположительно из-за снижения бактериальной нагрузки, после лечения часто наблюдается рецидив, так как популяция бактерий восстанавливается, а антибиотики редко полностью устраняют основное заболевание (15, 21, 22). Обычно используются метронидазол (10-15 мг/кг каждые 12 ч) и тилозин (25 мг/ кг каждые 12 ч) в течение 4-6 недель, но, как отмечалось выше, оба препарата вызывают дисбиоз толстого кишечника, который иногда может продолжаться месяцами (8, 9, 11).
В исследованиях было показано, что у собак с острой диареей метронидазол способствует развитию длительного дисбиоза (11), а амоксициллин-клавулановой кислотой — росту резистентной кишечной палочки (23). Применять антибиотики в качестве первой линии терапии ХЭ обычно не рекомендуется по целому ряду причин: ответ на антибиотики достигается только у 10-16% собак с ХЭ, в большинстве случаев после отмены лечения происходят рецидивы, а препараты оказывают негативное влияние на микробиом. Тем не менее после неудачных попыток лечения путем изменения диеты и применения противовоспалительных препаратов или при симптомах системного воспаления (16), а также инвазии и персистенции бактерий в слизистую кишечника (например, при гранулематозном колите, вызванном E. сoli) следует рассмотреть вопрос о назначении антибиотиков. Небольшая часть собак с ХЭ могут не отвечать ни на какое другое лечение, и в этом случае требуется длительное применение препарата с уменьшением дозы до минимально эффективной.
В некоторых случаях дисбиоза восстановить нормальную микробиоту и улучшить клинические показатели позволяет трансплантация фекальной микробиоты (FMT) (11). Этот метод заключается в переносе фекалий от здорового донора в кишечник реципиента с помощью перорально принимаемых капсул, эндоскопии или клизмы (Рисунки 5 и 6). У человека FMT показывает высокую эффективность (>90%) при инфекционных заболеваниях и рецидивирующей инфекции C. difficile, но менее эффективна при воспалительных заболеваниях кишечника, поскольку в этом случае воспаление в кишечнике носит хронический характер.
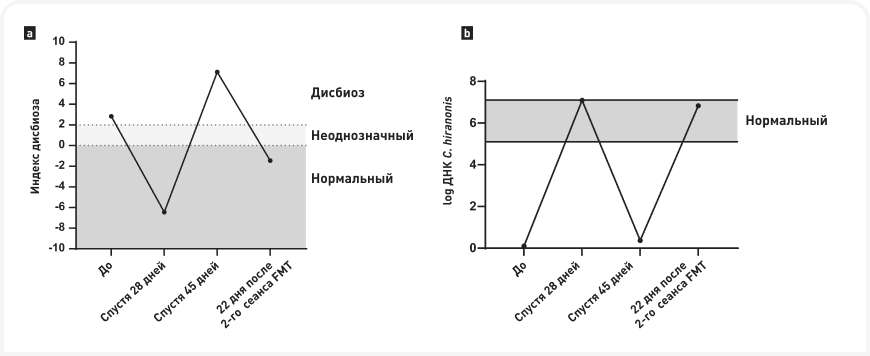
У животных FMT пока остается в стадии исследований. Простой протокол лечения представлен в Блоке 4, хотя до настоящего времени было описано лишь несколько серий клинических наблюдений, причем эффективность лечения зависела от основного заболевания (24). Этот метод помогает восстановить метаболизм желчных кислот путем повышения уровня C. hiranonis (Рисунок 7), поэтому может быть полезен для собак с нарушением преобразования желчных кислот, сопровождающимся избыточным ростом кишечных патогенов, таких как C. difficile или C. perfringens, и/или у животных с дисбиозом, вызванным антибиотиками, и незначительным повреждением слизистой кишечника. Также было показано, что он улучшает консистенцию фекалий при острой диарее и в случаях, когда используется в качестве дополнения к стандартной антимикробной терапии у щенков с парвовирусной инфекцией и у молодых собак с хронической диареей, вызванной подтвержденной инфекцией C. difficile (25).
Микробиом кишечника играет важнейшую роль в сохранении здоровья организма-хозяина, а у многих животных с заболеваниями желудочно-кишечного тракта развивается дисбиоз с нарушением функции микробной популяции, что может способствовать развитию клинических проявлений заболевания. Во многих случаях для диагностики полезен индекс дисбиоза. Причины заболевания могут быть различными, поэтому лечение, направленное на улучшение состава микробиоты, должно быть мультимодальным и часто длительным.
Раскрытие информации: автор является сотрудником лаборатории по изучению желудочно-кишечного тракта Техасского университета A&M, США, предлагающей услуги по анализу микробиома на коммерческой основе.
Функция микробиома

Оценка микробиома
Бактериальный посев
Молекулярное секвенирование генов 16S рРНК
Индекс дисбиоза (ИД) микробиоты у собак
.png)
Микробиом при заболеваниях

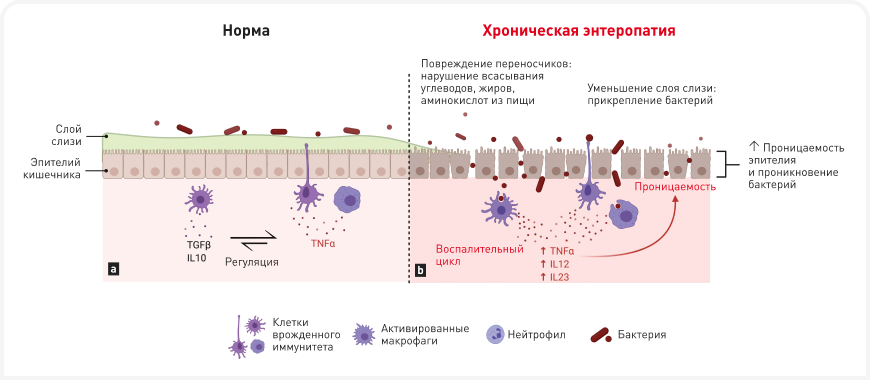
Из-за разрушения слоя слизи, покрывающего эпителий, при ХЭ у собак часто увеличивается количество бактерий, прикрепившихся к слизистой оболочке кишечника (15). Это связано с уменьшением количества C. hiranonis, а значит, с нарушением преобразования желчных кислот, что стимулирует избыточный рост C. difficile и C. perfringens, а это, в свою очередь, может привести к усилению провоспалительной реакции.
Диагностика дисбиоза
Изменения состава микробиоты в тонком кишечнике часто приводят к заметным изменениям фекального микробиома, оцениваемого по ИД. Однако у некоторых пациентов повышенное количество бактерий в тонком кишечнике может стать причиной заболевания. На дисбиоз тонкого кишечника указывает повышение концентрации фолатов и снижение уровня кобаламина в сыворотке крови, однако следует учитывать, что чувствительность и специфичность обоих этих маркеров низкая.
Терапия дисбиоза
Пробиотики могут назначаться как отдельно (в легких случаях), так и вместе с изменением диеты. Поскольку количество бактерий, входящих в состав любого пробиотика, по сравнению с существующей микробиотой кишечника невелико, его прямое влияние на состав микробиоты незначительно. Однако бактерии прикрепляются к слизистой и могут оказывать благоприятное воздействие, включая сокращение продолжительности острой диареи и уменьшение таких побочных эффектов приема антибиотиков, как рвота или диарея (18). Было показано, что высокоактивные мультиштаммовые пробиотики уменьшают количество C. perfringens у собак с острой геморрагической диареей (19) и укрепляют кишечный барьер у собак с ХЭ (20). Однако, поскольку многие коммерческие продукты не имеют необходимого контроля качества, важно выбрать препарат, эффективность которого доказана в опубликованных клинических исследованиях.
Пребиотики — это неперевариваемые углеводы, способствующие росту полезных микроорганизмов, они разделяются на растворимые/нерастворимые и ферментируемые/неферментируемые. Ферментируемые пребиотики преобразуются бактериями толстой кишки в КЦЖК. Большинство промышленных кормов, предназначенных для животных с заболеваниями ЖКТ, содержат пребиотики, но при некоторых заболеваниях (например, колите) диеты с высоким содержанием клетчатки могут быть особенно полезны.


У собак с ХЭ дисбиоз имеет вторичный характер, развиваясь вследствие воспаления и структурных повреждений кишечника, и, если не устранить основную патологию, дисбиоз и клинические проявления будут рецидивировать. Таким образом, эффективность FMT при ХЭ очень вариабельна, и, по данным единичных наблюдений, у многих собак с ХЭ консистенция фекалий в течение 2-3 дней после проведенного лечения улучшается, но через несколько недель заболевание рецидивирует и развивается повторная диарея. Таким пациентам необходимо соответствующее диетическое и противовоспалительное лечение основного заболевания (см. выше), а FMT можно считать дополнительным методом лечения при неоптимальном ответе (например, сохраняющемся мягком стуле) на стандартные методы лечения.

Заключение
-
1.Ziese AL, Suchodolski JS. Impact of changes in gastrointestinal microbiota in canine and feline digestive diseases. Vet. Clin. North. Am. Small. Anim. Pract. 2021;51(1):155-169.
-
2.Whitfield-Cargile CM, Cohen ND, Chapkin RS, et al. The microbiota-derived metabolite indole decreases mucosal inflammation and injury in a murine model of NSAID enteropathy. Gut. Microbes. 2016;7(3):246-261.
-
3.Giaretta PR, Suchodolski JS, Blick AK, et al. Distribution of bile acid receptor TGR5 in the gastrointestinal tract of dogs. Histol. Histopathol. 2019;34(1):69-79.
-
4.Li Q, Larouche-Lebel E, Loughran KA, et al. Gut dysbiosis and its associations with gut microbiota-derived metabolites in dogs with myxomatous mitral valve disease. MSystems. 2021;in press.
-
5.Pavlidis P, Powell N, Vincent RP, et al. Systematic review: bile acids and intestinal inflammation-luminal aggressors or regulators of mucosal defence? Aliment. Pharmacol. Ther. 2015;42(7):802-817.
-
6.Werner M, Suchodolski JS, Lidbury JA, et al. Diagnostic value of fecal cultures in dogs with chronic diarrhea. J. Vet. Intern. Med. 2021;35(1):199-208.
-
7.Al Shawaqfeh MK, Wajid B, Minamoto Y, et al. A dysbiosis index to assess microbial changes in fecal samples of dogs with chronic inflammatory enteropathy. FEMS Microbiol. Ecol. 2017;93(11): DOI: 10.1093/femsec/fix136
-
8.Pilla R, Gaschen FP, Barr JW, et al. Effects of metronidazole on the fecal microbiome and metabolome in healthy dogs. J. Vet. Intern. Med. 2020;34(5):1853-1866.
-
9.Manchester AC, Webb CB, Blake AB, et al. Long-term impact of tylosin on fecal microbiota and fecal bile acids of healthy dogs. J. Vet. Intern. Med. 2019;33(6):2605-2617.
-
10.Wang S, Martins R, Sullivan MC, et al. Diet-induced remission in chronic enteropathy is associated with altered microbial community structure and synthesis of secondary bile acids. Microbiome 2019;7(1):126.
-
11.Chaitman J, Ziese AL, Pilla R, et al. Fecal microbial and metabolic profiles in dogs with acute diarrhea receiving either fecal microbiota transplantation or oral metronidazole. Front. Vet. Sci. 2020;7:192.
-
12.Blake AB, Guard BC, Honneffer JB, et al. Altered microbiota, fecal lactate, and fecal bile acids in dogs with gastrointestinal disease. PLOS One 2019;14(10):e0224454.
-
13.Isaiah A, Parambeth JC, Steiner JM, et al. The fecal microbiome of dogs with exocrine pancreatic insufficiency. Anaerobe 2017;45:50-58.
-
14.Giaretta PR, Rech RR, Guard BC, et al. Comparison of intestinal expression of the apical sodium-dependent bile acid transporter between dogs with and without chronic inflammatory enteropathy. J. Vet. Intern. Med. 2018;32(6):1918-1926.
-
15.Giaretta PR, Suchodolski JS, Jergens AE, et al. Bacterial biogeography of the colon in dogs with chronic inflammatory enteropathy. Vet. Pathol. 2020;57(2):258-265.
-
16.Procoli F. Inflammatory bowel disease, food-responsive, antibiotic-responsive diarrhoea, protein losing enteropathy. Advance Small Anim. Care 2020;1:127-141.
-
17.Bresciani F, Minamoto Y, Suchodolski JS, et al. Effect of an extruded animal protein-free diet on fecal microbiota of dogs with food-responsive enteropathy. J. Vet. Intern. Med. 2018;32(6):1903-1910.
-
18.Torres-Henderson C, Suchodolski J, Lappin MR. Effect of Enterococcus faecium strain SF68 on gastrointestinal signs and fecal microbiome in cats administered amoxicillin-clavulanate. Top. Companion Anim. Med. 2017;32(3):104-108.
-
19.Ziese AL, Suchodolski JS, Hartmann K, et al. Effect of probiotic treatment on the clinical course, intestinal microbiome, and toxigenic Clostridium perfringens in dogs with acute hemorrhagic diarrhea. PLOS One 2018;13(9):e0204691.
-
20.White R, Atherly T, Guard B, et al. Randomized, controlled trial evaluating the effect of multi-strain probiotic on the mucosal microbiota in canine idiopathic inflammatory bowel disease. Gut Microbes 2017;8(5):451-466.
-
21.Westermarck E, Skrzypczak T, Harmoinen J, et al. Tylosin-responsive chronic diarrhea in dogs. J. Vet. Intern. Med. 2005;19(2):177-186.
-
22.Westermarck E, Myllys V, Aho M. Effect of treatment on the jejunal and colonic bacterial flora of dogs with exocrine pancreatic insufficiency. Pancreas 1993;8:559-562.
-
23.Werner M, Suchodolski JS, Straubinger RK, et al. Effect of amoxicillin-clavulanic acid on clinical scores, intestinal microbiome, and amoxicillin-resistant Escherichia coli in dogs with uncomplicated acute diarrhea. J. Vet. Intern. Med. 2020;34(3):1166-1176.
-
24.Chaitman J, Gaschen F. Fecal microbiota transplantation in dogs. Vet. Clin. North. Am. Small Anim. Pract. 2021;51(1):219-233.
-
25.Pereira GQ, Gomes LA, Santos IS, et al. Fecal microbiota transplantation in puppies with canine parvovirus infection. J. Vet. Intern. Med. 2018;32(2):707-711.




 2084
2084  15 мин
15 мин












