Введение
Инфекционный перитонит кошек (Feline Infectious Peritonitis, FIP, или ИПК) развивается в результате мутации широко распространенного и относительно неопасного коронавируса кошек (FCoV). Заболевание было впервые описано в 1963 году (1), его распространение и повышение первичной заболеваемости с момента его открытия связывают с групповым содержанием животных, прежде всего в питомниках и приютах. Первый помет котят для продажи был зарегистрирован в США в 1947 году (2) – это отражает тот факт, что кошек стали воспринимать как животных-компаньонов, содержащихся в основном в помещении. В последующие десятилетия число питомников и приютов значительно возросло, что создало благоприятные условия для передачи и распространения инфекционных заболеваний кошек при групповом содержании. Применяемые на данный момент методы медикаментозной профилактики и терапии редко дают эффект, более того: поставить диагноз при жизни животного часто оказывается проблематично. Ведутся исследования, направленные на поиск действенных инструментов диагностики (в том числе секвенирования). Новые методы лечения проходят клинические испытания. В обоих направлениях достигнуты перспективные результаты.
Этиология и патогенез
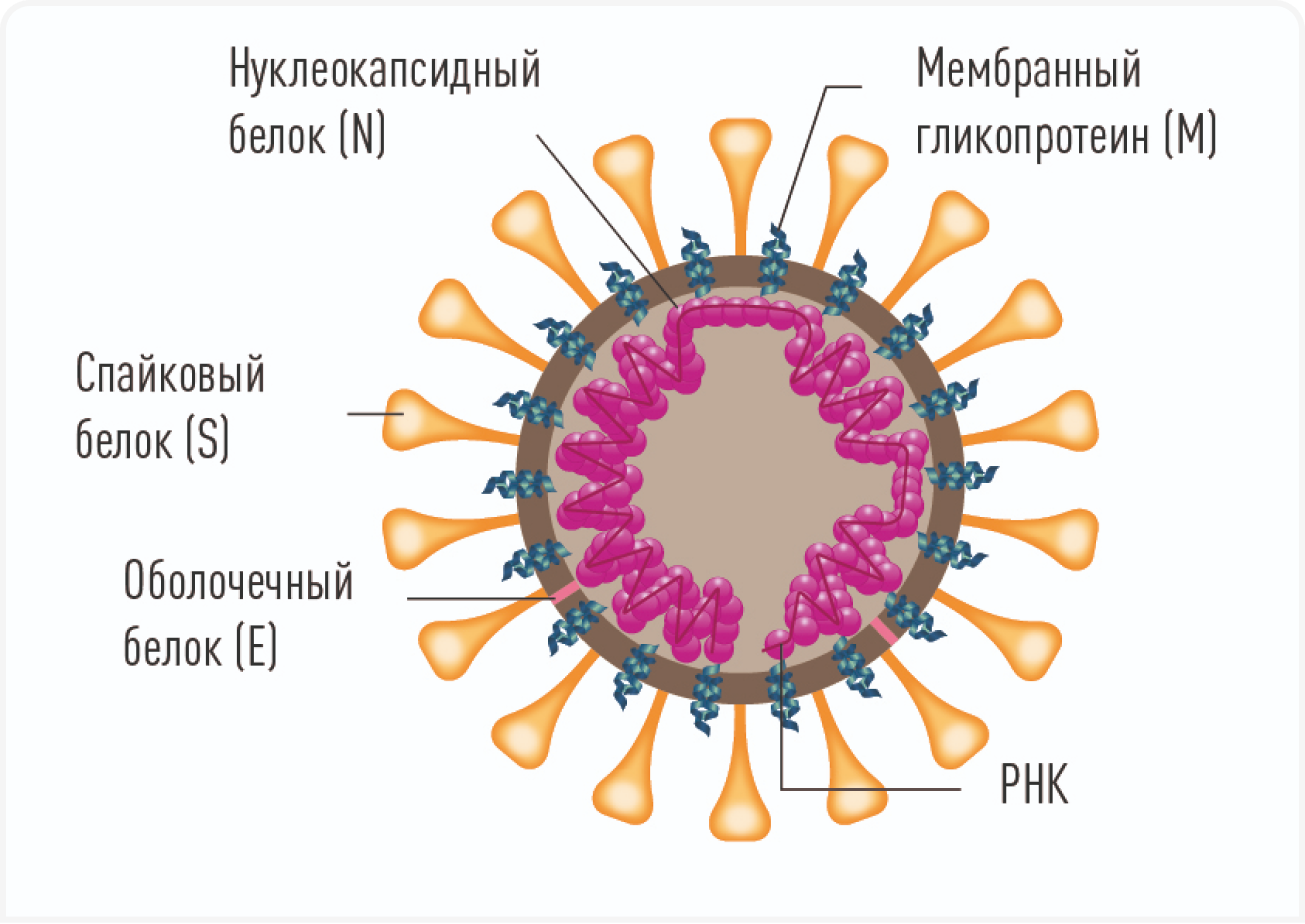
Коронавирус кошек — крупный оболочечный вирус, содержащий одноцепочечную (+) РНК. Коронавирусы в целом демонстрируют высокую частоту мутаций во время репликации, что приводит к внутривидовой и межвидовой рекомбинации и к повышению риска передачи. В настоящее время принято считать, что существует два серотипа FCoV: тип I — наиболее часто встречающаяся во всем мире форма (с некоторыми географическими вариациями), и тип II, произошедший от рекомбинации типа I с коронавирусом собак. И, хотя тип I доминирует в инфицировании кошек естественным путем, основная масса исследований посвящена типу II, поскольку он быстрее реплицируется в лаборатории. Оба серотипа FCoV связаны с развитием FIP (3). Тип I и тип II имеют генетические различия в белке S (spike, шип (Рисунок 1)), который, как считается, играет важную роль в мутировании обычного коронавируса (FCoV) в коронавирус, вызывающий FIP (FIPV).
Основной путь передачи коронавируса — фекально-оральный, вирус инфицирует животное ороназальным способом при прямом контакте или через фомиты, например туалетные лотки или поверхности. После внедрения FCoV перемещается в кишечные энтероциты, где происходит его репликация. Инфекция, вызванная FCoV, часто имеет субклиническое течение, но может проявляться саморазрешающейся диареей, когда вирус повреждает клетки кишечного эпителия.
Трансформация обычного FCoV в летальный вирус FIPV происходит из-за точечных мутаций в геноме РНК. Особый интерес в этом отношении представляют спайк (S) и мембранные (M) белки вируса, которые контролируют проникновение вируса в клетки и выход из них
(Рисунок 1). Понимание специфики точечных мутаций, по всей видимости, является ключевым моментом для предотвращения этой смертоносной трансформации. В настоящее время основные исследования в первую очередь сосредоточены на изучении генов S и 3c, при этом ген S в лабораторных условиях изучается наиболее часто (4).
Первичными воспалительными клетками при FIP являются макрофаги. Точечные мутации в геноме FCoV «переключают» вирус с тропности к эпителиальным клеткам на тропность к макрофагам. Такой вирус становится способен перемещаться и реплицироваться в макрофагах, попадая вместе с ними в различные органы и ткани. Инфицированные макрофаги поглощают антигены, позволяя вирусу избежать антителозависимого лизиса, и в то же время активируют систему комплемента, что повышает миграцию других воспалительных клеток к инфицированным тканям. Гуморальный иммунитет также активируется, что приводит к отложению комплексов антитело-антиген на стенках кровеносных сосудов, вызывая выраженный распространенный васкулит.

«
«FCoV — широко распространенный вирус, серопревалентность которого более высока в местах группового содержания животных, например в питомниках и приютах».
Приблизительно в 50% случаев FIP развивается влажная (выпотная, эффузионная) форма, в то время как в других 50% случаев наблюдается сухая форма, в основном с гранулематозными проявлениями. Тем не менее классическое разделение на две четко разграниченные формы здесь неприменимо, поскольку заболевание проявляется целым спектром форм в широком диапазоне от «чистой» выпотной до «чистой» невыпотной. Предполагается, что такая вариативность зависит от того, какой тип иммунного ответа наиболее активен: гуморальный иммунитет приводит к развитию экссудативной формы заболевания, а система комплемента — к преобладанию гранулематозных проявлений (5).
Распространенность и факторы риска
FCoV — широко распространенный вирус, его серопревалентность варьируется от 25% в домохозяйствах с одним животным до 75–100% в местах группового содержания кошек, таких как питомники и приюты (6,7). Мутация вируса в FIPV происходит достаточно редко; частота заболеваемости FIP в популяциях серопозитивных по FCoV кошек варьируется от 1 до 12%, при этом максимальные цифры отмечаются в более ранних исследованиях, которые проводились в основном в питомниках кошек (8,9). В целом, по оценкам, основанным на опубликованных данных, предполагается, что после контакта с вирусом FCoV 5–10% кошек будут невосприимчивы к нему, 70–75% перенесут инфекцию с последующей элиминацией вируса в срок от нескольких недель до нескольких месяцев, 10–15% станут хроническими носителями, выделяющими вирус, и менее чем у 3% разовьется FIP (8).
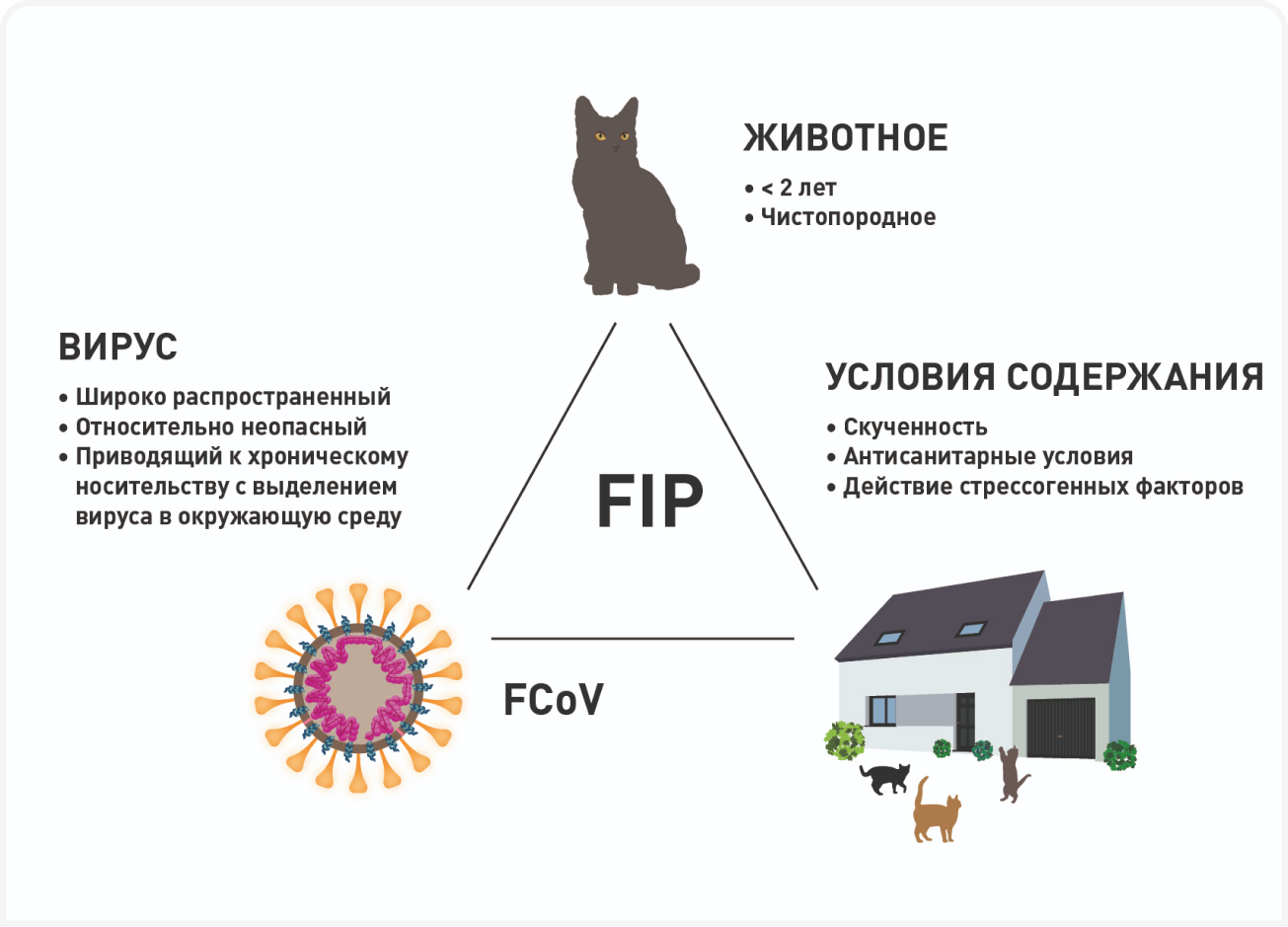
Наиболее распространенная гипотеза «внутренней мутации» постулирует, что точечные мутации, приводящие к появлению вируса FIPV, происходят у определенных кошек и основаны на взаимодействии факторов со стороны вируса (определенные штаммы FCoV и их мутагенность) с факторами окружающей среды (перенаселение и вирусная нагрузка) и факторами, связанными с конкретными кошками (генетическая предрасположенность, иммунный ответ). Поэтому до недавнего времени считалось, что FIP не передается горизонтальным путем от кошки к кошке. Тем не менее благодаря технологии молекулярного секвенирования были выявлены редкие вспышки инфицирования одним и тем же вирусом FIPV в некоторых группах кошек (10). Вирус FIPV по-прежнему считается в основном нетрансмиссивным, хотя присутствие в популяции высокоопасных и средневирулентных штаммов, передающихся от кошки к кошке, может указывать на повышенный риск мутации вируса в FIPV и его дальнейшей передачи.
FIP в большинстве случаев рассматривается как заболевание, которое поражает молодых кошек (меньше 2 лет). Котята, как правило, получают более высокую вирусную нагрузку, чем взрослые кошки, чаще сталкиваются со стрессовыми факторами (такими как вакцинация, кастрация, переезд в новый дом) и обладают незрелой иммунной системой. И хотя существует субпопуляция кошек, у которых мутации высокого риска исключаются (как показано в нескольких лабораторных исследованиях с провокационным испытанием), у большинства кошек, у которых развивается FIP, это происходит после первого контакта с вирусом FCoV, то есть обычно в том возрасте, когда они еще являются котятами (5,8). К дополнительным факторам риска мутации относят чистопородность и групповое содержание, особенно в перенаселенных или антисанитарных условиях, где присутствует высокая вирусная нагрузка и факторы, генерирующие физиологический стресс (Рисунок 2). И наконец, более ранние исследования показали, что риск развития FIP повышается у кошек, инфицированных FeLV (ВЛК) или FIV (ВИК), хотя подобные находки не были систематическими (11,12).
Клинические проявления
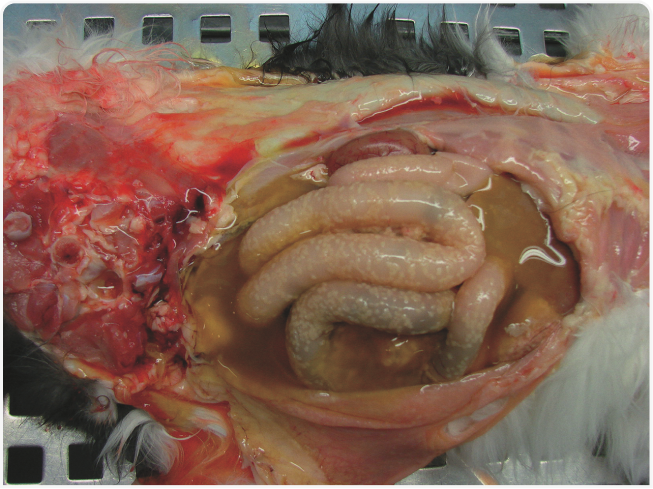
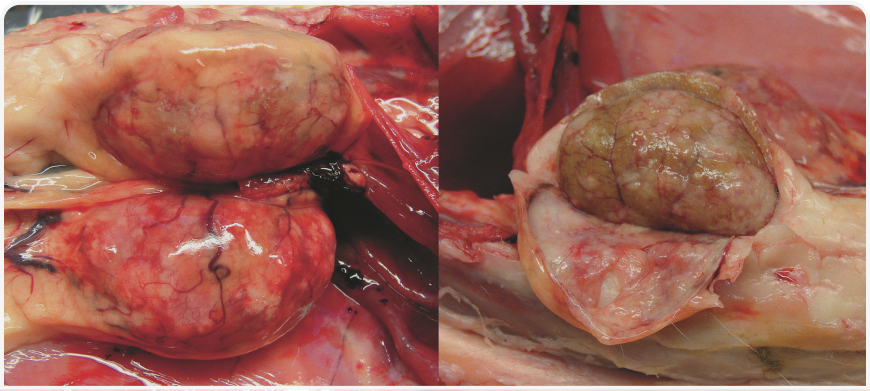
Обычно описывают две классические клинические формы FIP: «влажную» (выпотную) и «сухую» (невыпотную). Однако в естественных условиях FIP обычно проявляется целым спектром форм, и случаи, характеризующиеся только выпотом или только гранулематозными поражениями, представляют собой лишь «крайние точки» этого спектра. Чаще всего имеет место сочетание различных симптомов. Трудности в диагностике FIP обусловлены неспецифичностью клинических признаков, недостатком патогномоничных изменений в клинических и биохимических показателях крови и низкой чувствительностью методов, используемых в настоящее время в клинической практике для обследования животных.Течение болезни с периодическими улучшениями и ухудшениями состояния или персистирующая лихорадка и отсутствие аппетита — наиболее часто отмечающиеся ранние клинические признаки. Симптомы FIP на ранней стадии можно принять за проявления других, более распространенных инфекционных заболеваний, в том числе панлейкопении и респираторных инфекций, в особенности у котят. Наличие выпота — специфичный признак, играющий важнейшую роль в постановке диагноза. У кошек с выпотной формой часто наблюдаются увеличение размеров живота, одышка, иктеричность или бледность слизистых. При невыпотной форме часто встречаются офтальмологические (увеит, ирит, преципитаты на роговице) и неврологические нарушения. Их наличие может дать основания для подозрения на FIP. Выпотную форму следует дифференцировать прежде всего от новообразований (в частности лимфомы), сердечной недостаточности и других патологий, при которых возможно развитие плеврита и перитонита. При невыпотной форме FIP клиническая картина может быть сходной с проявлениями токсоплазмоза, лейкоза (FeLV), иммунодефицита кошек (FIV) и онкологических заболеваний (лимфома, аденокарцинома и другие). Клинические признаки развиваются вследствие скопления комплексов антиген-антитело на стенках кровеносных сосудов. Результатом этого становится фибринозный и/или гранулематозный васкулит, характерные признаки которого выявляют на образцах тканей, взятых при хирургическом вмешательстве или уже при вскрытии. Жидкость устремляется из пораженных сосудов в полости тела, что приводит к появлению выпота в плевральной, перикардиальной и/или брюшной полости (Рисунок 3). Патологические изменения в паренхиматозных органах представляют собой главным образом множественные, иногда сливающиеся между собой скопления гранулем, часто расположенные по ходу кровеносных сосудов (Рисунки 4 и 5).

Методы диагностики
На данный момент наиболее точно диагностировать FIP можно путем идентификации вируса FCoV или FIPV в тканевых макрофагах при помощи иммуногистохимического анализа и/или ПЦР с обратной транскрипцией (RT-PCR). Однако для проведения указанных исследований требуются образцы тканей, взятые методом биопсии в ходе хирургической операции или при вскрытии. Таким образом, неинвазивные методы для постановки диагноза при жизни животного недоступны. Прижизненный диагноз часто носит предположительный характер и основывается на вдумчивой оценке истории болезни, на данных осмотра, результатах общего клинического и биохимического исследования крови и (при наличии выпота) анализа выпотной жидкости (Информационный блок 1).
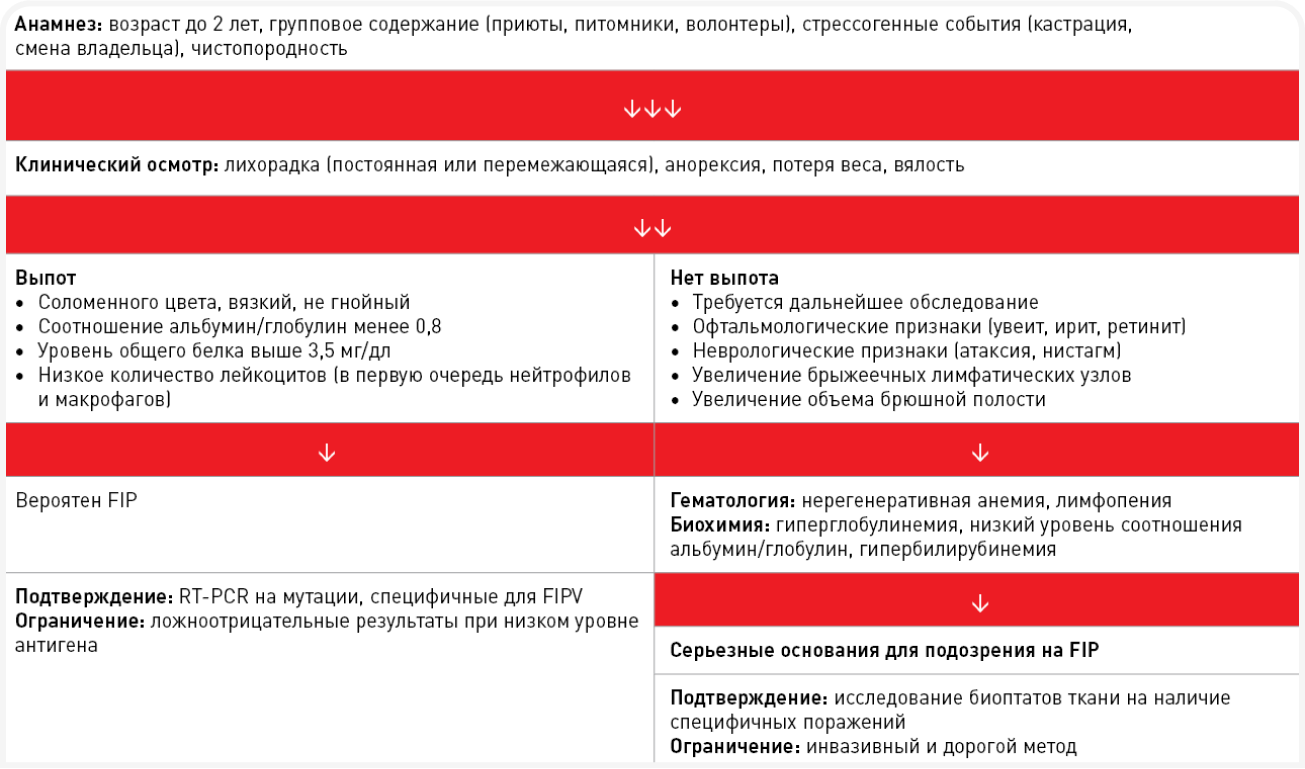
Патогномоничных для FIP изменений показателей крови не существует. Чаще всего при проведении общего анализа крови выявляют нерегенеративную анемию с лимфопенией, но обычно без нейтрофильного лейкоцитоза, часто встречающегося на стрессовой лейкограмме. Биохимические показатели сыворотки крови характеризуются повышением уровня общего белка вследствие развития гиперглобулинемии у большинства кошек (13). Среди других показателей, свойственных FIP, – повышение уровня печеночных ферментов и билирубина вследствие поражения печени.
Исследование выпотной жидкости является наиболее точным методом прижизненной диагностики FIP. При подозрении на FIP весомым доводом в пользу этого диагноза служит уровень общего белка выше 3,5 мг/дл и минимальное количество клеток. Соотношение альбумин/глобулин менее 0,8 в выпотной жидкости также подкрепляет подозрение на FIP. Иммуноокрашивание экссудата (эффузионной жидкости) для поиска антигена FCoV не считается чувствительным методом диагностики, поскольку в ней содержится мало клеток и/или антигены часто маскируются связанными с ними антителами (14).
Метод RT-PCR для определения FIPV (не FCoV) в выпотной жидкости обладает достаточно высокой специфичностью (95,8%), но довольно низкой чувствительностью (68,6%). Сейчас это наиболее эффективный неизвазивный метод для подтверждения диагноза FIP. При положительном результате этот тест выявляет специфические мутации в спайковом белке (S), ассоциируемые с вирусом FIPV. У кошек с выпотом распространенность FIP составляет около 50–60%. В этих случаях диагностическая ценность положительного результата RT-PCR на FIPV составляет около 95%. Этот тест не рекомендуется проводить на образцах крови, сыворотки или кала из-за крайне малого количества антигенов и комплексов антиген-антитело. Кроме того, у многих кошек одновременно присутствуют разные штаммы коронавируса, что также может ограничить ценность теста.
Важно, что положительный результат серологического исследования на антитела к FCoV никогда нельзя считать основанием для постановки диагноза FIP. Серологические тесты не позволяют различить антитела к «обычным» коронавирусам и к коронавирусам, вызывающим FIP.
Лечение
Считается, что FIP всегда приводит к гибели животного, хотя иногда встречаются редкие упоминания о затяжном течении болезни или даже о выздоровлении. Обычно FIP прогрессирует быстро, медианное время выживания после постановки диагноза составляет 9 дней (15). Для лечения на основании исследований in vitro или на других животных ранее предлагались различные антивирусные препараты, такие как рибавирин, видарабин, человеческий интерферон-альфа и кошачий интерферон-омега (13), но они оказались неэффективными при FIP. Доступные в настоящее время паллиативные меры — это, в частности, назначение иммуносупрессоров, которые могут оказывать некоторое влияние на развитие клинических признаков. Чаще всего это преднизолон и дексаметазон, но также применяют циклофосфамид или хлорамбуцил (13). Применение некоторых неспецифических иммуностимуляторов в отдельных случаях повышало время выживания кошек, но таких сведений мало, и в данный момент эти препараты не рекомендованы для лечения FIP (16).
В настоящее время активно ведутся исследования, посвященные методам лечения FIP, причем некоторые пока не завершенные эксперименты показывают многообещающие результаты. Иммуностимулятор Полипренил (PPI) прошел многочисленные лабораторные и клинические испытания для применения на ранних стадиях невыпотной формы FIP (17); более того, PPI доступен в продаже и лицензирован в некоторых странах для лечения респираторных инфекций верхних дыхательных путей у кошек. Другое перспективное направление исследований — ингибитор протеазы GC376, который как в лабораторных условиях, так и в клинических испытаниях с участием кошек с FIP позволил добиться временного снижения выраженности симптомов (18). Ожидается, что в США GC376 будет разрешен к применению и появится в продаже в ближайшие несколько лет (19). Недавнее исследование ингибиторов транскрипции РНК (EVO984/GS441524) показало резкое снижение интенсивности репликации вируса in vitro и ремиссию заболевания у 10 из 10 кошек, инфицированных экспериментальным путем (20).

«
«Офтальмологическое обследование на предмет выявления ирита, увеита или повреждений сетчатки во многих случаях является важным компонентом постановки диагноза FIP».

Вакцинация
В настоящее время в США, Европе и Канаде в продаже присутствует один вид вакцины против FIP. Это модифицированная живая вакцина для интраназального введения, содержащая мутантный штамм FCoV. Американская ассоциация ветеринарных врачей, работающих с кошками (AAFP), подразделяет вакцины на три группы: основные, дополнительные и обычно не рекомендуемые, и, по мнению Консультационного совета AAFP по вакцинации кошек, существующая вакцина против FIP относится к числу нерекомендуемых, поскольку «данных о том, что она обеспечивает клинически значимую защиту, недостаточно» (21).
Профилактика FIP у кошек, находящихся в контакте с вирусом
Как было сказано выше, считается, что вирус FIPV в большинстве случаев не передается горизонтальным путем, поэтому эпизоотии FIP случаются крайне редко. Тем не менее, когда у кошки или котенка развивается FIP, всегда возникает вопрос, каков риск передачи вируса другим кошкам, бывшим в контакте с этим животным. Считается, что для кошек, контактировавших с инфицированным животным, но не находящихся с ним в родстве, риск развития FIP низок, в силу теории «внутренней мутации», которая излагалась выше. Однако кошки, находящиеся в родстве с таким животным, относятся к группе более высокого риска, поскольку они, вероятно, инфицированы тем же штаммом вируса и имеют генетическую предрасположенность к мутации. Более того, вероятность этого многократно повышается в том случае, если кошки живут в одной среде и подвергаются воздействию одних и тех же стрессогенных факторов. Таким образом, однопометники заболевших котят находятся в зоне наибольшего риска по развитию FIP и нуждаются в тщательном наблюдении для своевременного выявления настораживающих симптомов.
Конечно, инкубационный период, предшествующий развитию FIP, может длиться от нескольких месяцев до нескольких лет. Существующие на данный момент диагностические тесты не позволяют предположить, какова вероятность развития заболевания у кошек, столкнувшихся с вирусом, но молекулярное секвенирование вируса FCoV для поиска точечных мутаций может стать тем инструментом, который в будущем изменит эту ситуацию.
Профилактика FIP при групповом содержании кошек
FCoV может выживать в сухой среде до семи недель, но легко инактивируется обычными моющими и дезинфицирующими средствами. При групповом содержании кошек меры профилактики и контроля FIP должны быть направлены на минимизацию факторов риска развития заболевания, включая максимальное снижение вероятности контакта с вирусом. В приютах должны быть внедрены протоколы тщательной санитарной обработки и дезинфекции. Гигиена лотков должна включать в себя частую уборку твердых отходов (как минимум один раз в день) и использование одноразового наполнителя в лотках для кошек и котят с диареей. Необходимо избегать перенаселения, в приютах должны соблюдаться нормы по количеству кошек и охране их здоровья (22). В идеале не следует размещать совместно котят из разных пометов, чтобы избежать перекрестного заражения вирусными инфекциями и риска рекомбинации штаммов. Тем не менее заболеваемость FIP на уровне 1% обычно считается неизбежной в популяциях кошек. В питомниках или приютах с более высокой встречаемостью FIP следует провести оценку протоколов уборки и дезинфекции, условий содержания, размещения кошек и обращения с ними, а также управления стрессогенными факторами.
Заключение
FIP — чрезвычайно тяжелое заболевание, которое развивается в результате действия комплекса факторов: мутаций штаммов FCoV, иммунного статуса животного, условий его содержания (включая инфекционную нагрузку). Ученые работают над тем, чтобы выявить точки мутации, способы раннего распознавания патологии и оценки риска ее развития, методы, помогающие замедлить или обратить вспять прогрессирование заболевания. В последние два года были получены многообещающие результаты исследований в области лечения FIP, и они могут уже сейчас применяться для паллиативного лечения отдельных кошек с FIP в частной клинической практике. Эрадикация FCoV на данный момент является недостижимой целью, но минимизация вирусной нагрузки и контактов с инфицированными животными — наилучший способ снижения частоты развития FIP в популяциях кошек.
Литература
- Holzworth J. Some important disorders of cats. Cornell Vet 1963; 53:157-160.
- Gross D. How kitty litter went from happy accident to $2 billion industry. Washington Post Feb 2, 2015.
- Benetka V, Kübber-Heiss A, Kolodziejek J, et al. Prevalence of feline coronavirus types I and II in cats with histopathologically verified feline infectious peritonitis. Vet Microbiol 2004;99(1):31-42.
- Oguma K, Ohno M, Yoshida M, et al. Mutation of the S and 3c genes in genomes of feline coronaviruses. J Vet Med Sci 2018;80(7):1094-1100.
- Pedersen NC. An update on feline infectious peritonitis: virology and immunopathogenesis. Vet J 2014;201(2):123-132.
- Addie D. Clustering of feline coronaviruses in multicat households. Vet J 2000;159:8-9.
- Pedersen NC, Sato R, Foley JE, et al. Common virus infections in cats, before and after being placed in shelters, with emphasis on feline enteric coronavirus. J Feline Med Surg 2004;6(2):83-88.
- Addie D. Feline coronavirus infections. In: Greene CE (ed). Infectious Diseases of the Dog and Cat, 4th ed. Oxford, Saunders 2012;92-108.
- Addie D, Jarrett O. A study of naturally occurring feline coronavirus infections in kittens. Vet Rec 1992;130:133-137.
- Wang YT, Su BL, Hsieh LE, et al. An outbreak of feline infectious peritonitis in a Taiwanese shelter: Epidemiologic and molecular evidence for horizontal transmission of a novel type II feline coronavirus. Vet Res 2013;44(1):1.
- Foley JE. Patterns of feline coronavirus infection and fecal shedding from cats in multiple-cat environments. J Am Vet Med Assoc 1997; 210(9):1307-1312.
- Poland AM, Vennema H, Foley JE, et al. Two related strains of feline infectious peritonitis virus isolated from immunocompromised cats infected with a feline enteric coronavirus. J Clin Microbiol 1996;34(12): 3180-3184.
- Addie DD, Belák S, Boucraut-Baralon C, et al. ABCD Guidelines on Feline Infectious Peritonitis. J Feline Med Surg 2009;11:594-604.
- Hartmann K, Binder C, Hirschberger J, et al. Comparison of different tests to diagnose feline infectious peritonitis. J Vet Intern Med 2003;17(6): 781-790.
- Ritz S, Egberink H, Hartmann K. Effect of feline interferon-omega on the survival time and quality of life of cats with feline infectious peritonitis. J Vet Intern Med 2007;21(6):1193-1197.
- Pedersen NC. An update on feline infectious peritonitis: Diagnostics and therapeutics. Vet J 2014;201(2):133-141.
- Legendre AM, Kuritz T, Galyon GD, et al. Polyprenyl immunostimulant treatment of cats with presumptive feline infectious peritonis in a field study. Front Vet Sci 2017;4;7.
- Pedersen NC, Kim Y, Liu H, et al. Efficacy of a 3C-like protease inhibitor in treating various forms of acquired feline infectious peritonitis. J Feline Med Surg 2018;20(4):378-392.
- Veterinary researchers and Anivive license antiviral drug for fatal cat disease [Internet]. Available at: www.k-state.edu/media/newsreleases/2018-09/fipantiviral92018.html [accessed Sep 30, 2018]
- Murphy BG, Perron M, Murakami E, et al. The nucleoside analog GS-441524 strongly inhibits feline infectious peritonitis (FIP) virus in tissue culture and experimental cat infection studies. Vet Microbiol 2018;219:226-233.
- Scherk MA, Ford RB, Gaskell RM, et al. Feline infectious peritonitis. J Feline Med Surg 2013;15:785-808.
- The Million Cat Challenge. Capacity for Care [Internet]. Available at: www.millioncatchallenge.org/resources/capacity-for-care [accessed Sep 30, 2018]



 3736
3736  15 мин
15 мин








