Введение
Обследование пожилых худых кошек с хронической болезнью почек (ХБП) – типичная ситуация в ветеринарной медицине. Было продемонстрировано, что кошки часто теряли в весе перед постановкой диагноза ХБП, при этом по мере прогрессирования этого заболевания часто отмечалась дальнейшая потеря массы тела (1). Такие клинические признаки, как рвота и дисрексия, зачастую очевидны у кошек с ХБП, и в недавно проведенном опросе владельцев кошек с ХБП 43% респондентов отметили у своих животных нарушения аппетита, вынуждающие владельцев тратить более 50% своего времени на то, чтобы побудить кошку съесть корм (2). Таким образом, снижение веса и потеря мышечной массы у данных пациентов скорее всего связаны с изменениями аппетита и такими процессами, как кахексия и саркопения.
Что следует знать о низкой степени упитанности?
Такие термины, как кахексия и саркопения, часто используются для описания худых пациентов, но важно понимать, как правильно использовать данные термины и что они означают.
• Кахексия представляет собой синдром, обычно связанный с раком и такими хроническими заболеваниями, как болезнь почек и сердца или респираторные заболевания. Данное состояние характеризуется потерей массы тела, потерей мышечной массы без снижения массы жировой ткани, а также системным воспалением. Кахексия часто связана с ухудшением аппетита и неправильным питанием (3, 4) и отличается от таких состояний, как саркопения, голодание, гипертиреоз и мальабсорбция. При кахексии отрицательный белково-энергетический баланс, развивающийся вследствие неправильного питания, сочетается с аномально ускоренным метаболизмом, что приводит к потере мышечной массы и снижению упитанности. Кроме того, системный воспалительный процесс приводит к катаболизму мышц посредством разрушения жиров и белка, а также к нарушению способности аминокислот стимулировать синтез белка (4). Кахексия является клинически значимым состоянием, поскольку связана с повышенной заболеваемостью и смертностью.
• Саркопения представляет собой снижение массы скелетной мускулатуры, ухудшение ее качеств и уменьшение силы, как часть нормального процесса старения, т. е. не связана с течением заболевания. Факторы, способствующие саркопении, включают возрастное снижение уровня нервных импульсов от головного мозга к мышцам, снижение физической активности, а также снижение способности к синтезу мышечного белка в сочетании с недостатком белка в рационе для поддержания мышечной массы (3, 4). Выявление саркопении может быть затруднено, поскольку общая масса тела может не меняться: потеря мышечной массы может сопровождаться повышением жировой массы. Существует очень мало информации по изменению упитанности кошек с возрастом.
И кахексия, и саркопения подразумевают дисфункцию мышц, способствующую общей слабости, и эти состояния могут клинически проявляться в виде упадка сил, гипорексии и заметного ухудшения качества жизни животного. Таким образом, данные синдромы могут иметь важные клинические последствия, и при любой возможности их следует выявлять и принимать соответствующие меры.
Было показано, что у некоторых биологических видов, в том числе кошек и собак, низкая степень упитанности при ХБП коррелирует с неблагоприятным прогнозом (Рисунок 1), и в недавно проведенном исследовании было продемонстрировано, что потеря массы тела связана с меньшим временем выживаемости кошек с ХБП (1).
Помимо таких осложнений, как гипертония, обезвоживание, анемия и гипокалиемия, каждое из которых способно отрицательно влиять на аппетит, нарушение стимуляции аппетита также наблюдалось при ХБП, что может способствовать дисрексии (5). У человека выявлено множество дополнительных факторов, которые могут способствовать кахексии при ХБП, включая гиперметаболизм, уремические токсины, метаболический ацидоз, воспаление и сопутствующие заболевания (6, 7). Существуют свидетельства того, что ХБП приводит к состоянию повышенного обмена веществ, еще более затрудняя адекватное питание (7). На самом деле, в медицине человека описан феномен «парадокса ожирения», когда у людей с более высокой оценкой упитанности (Body Condition Scoring – BCS) наблюдался более благоприятный клинический исход; белково-энергетическая недостаточность и низкая оценка BCS связаны со снижением выживаемости даже у пациентов на диализе (6).
Как проводить диагностическое обследование худой кошки с ХБП?
При работе с такими пациентами важно выявить как можно больше факторов, способствующих низкой упитанности. Как при диагностированной впервые, так и при долгосрочной ХБП ключевым будет выявление болезни и контроль осложнений болезни почек, способных влиять на аппетит (например, обезвоживание, тошнота, анемия, гипертония и дисбаланс электролитов). Помимо этого, поскольку в популяции пожилых кошек часто встречаются сопутствующие заболевания, критически важно выявить какие-либо иные причины потери массы тела, и необходимо провести полное диагностическое обследование. Таким образом, для худой кошки с ХБП следует в идеале провести биохимический анализ крови с анализом электролитов, общий анализ крови, цистоцентез для анализа мочи (Рисунок 2) (включая посев мочи и соотношение белок/креатинин в моче), измерить кровяное давление (Рисунок 3) и общий тироксин.
.png)
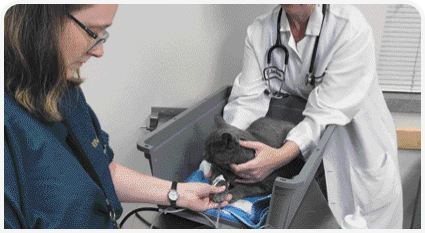
Общий анализ мочи – необходимая составляющая оценки состояния любой кошки с ХБП, однако получение образца мочи бывает проблематичным. Владелец животного может попробовать взять мочу в домашних условиях, однако многие кошки не любят использовать пустой лоток или невпитывающий наполнитель (a). Кроме того, образец мочи, полученный таким образом, может быть плохого качества. Забор мочи посредством катетеризации мочевого пузыря для кошек с ХБП не рекомендуется, поскольку при этом в нарушенную мочевыделительную систему заносятся бактерии.
Предпочтительным методом взятия качественного образца мочи является цистоцентез; он позволяет получить качественный образец мочи у большинства кошек и не требует седации или общей анестезии. Хотя спокойную кошку для проведения цистоцентеза может держать один человек, если при этом спина кошки упирается ему в живот (b, c), обычно требуется два ассистента, по одному с каждой стороны. Кошка должна лежать на правом боку (если врач — правша), при этом ее спину следует держать или подпирать, иначе она будет соскальзывать в направлении от врача. Задние конечности следует аккуратно растянуть в вентрально-каудальном направлении, однако не слишком сильно, иначе пациент может начать сопротивляться сильнее.
Клиницист пальпирует брюшную полость животного левой рукой и локализует мочевой пузырь краниально от большого пальца руки; легкое надавливание в области между большим пальцем и ладонью позволит зафиксировать мочевой пузырь и повысить интравезикальное давление, улучшив шансы на успех при маленьком мочевом пузыре. Иглу держат в правой руке под небольшим углом в сторону предполагаемого центра мочевого пузыря (c). Для обеспечения максимальной эффективности и безопасности шприц следует держать в руке таким образом, чтобы не понадобилось менять его положение в процессе взятия образца.
Провести забор мочи можно также посредством цистоцентеза под контролем УЗИ (см. ссылку на видео ниже). Данный метод обладает преимуществами для пациентов, у которых еще есть значительные жировые отложения на животе, а также для пациентов с болезненным мочевым пузырем, у которых он опорожняется сразу после начала пальпации и прежде, чем будет взят образец.
Кроме того, методы диагностической визуализации, такие как УЗИ брюшной полости и рентгенография, могут представлять определенную ценность для выявления уролитов и/или непроходимости уретры, в частности у кошек с недавно диагностированной ХБП либо при недавнем повышении значений параметров, связанных с работой почек. Необходимо определить, вызвана ли азотемия ХБП или такими процессами, как непроходимость уретры или инфекция. Выявление процессов, стоящих за потерей массы тела и мышечной массы при старении и болезни, в дополнение к диагностическому обследованию и определению воздействующих на организм заболеваний, позволит лучше понять, каким образом удовлетворить потребности таких пациентов.
Каковы особенности пожилых кошек?
Вероятность развития кахексии или саркопении у кошек, возможно, повышена благодаря нескольким уникальным характеристикам этого вида. Потребность в белке и аминокислотах у кошек выше, чем у других животных. При неадекватном питании организм получает энергию за счет мобилизации аминокислот из мышц, а не жировых запасов. Пожилые кошки также сильно отличаются от других видов, поскольку скорость их обмена веществ остается стабильной или повышается, а не снижается, и болезни могут способствовать гиперметаболическому состоянию (8). Кроме того, у пожилых кошек отмечалось снижение способности усваивать белки и жиры; таким образом, они еще сильнее подвержены риску развития кахексии и/или саркопении (9). Сочетание этих факторов создает необходимость уделять особое внимание питанию и использованию высококачественных легкоусвояемых кормов для таких животных вне зависимости от течения заболевания (8). В недавно проведенном исследовании по оценке качества жизни кошек с ХБП было выявлено, что у таких животных оценки по параметрам «аппетит» и «привлекательность корма» были достоверно ниже, чем у здоровых молодых или пожилых кошек (10). Таким образом, плохой аппетит воспринимается как серьезная причина для беспокойства о качестве жизни животного и может вызывать сильный эмоциональный стресс у его владельца, что нередко приводит к принятию решения об эвтаназии.
Что известно о патофизиологии дисрексии при ХБП?
Причину дисрексии при ХБП обычно связывают с результатами воздействия уремии на кишечный тракт, такими как гиперкислотность, азотемический гастрит и язва, однако пока нет окончательного понимания данной патофизиологии у кошек и собак. Было показано, что у кошек с ХБП наблюдаются повышенные концентрации гастрина, увеличивающиеся с повышением степени тяжести болезни почек (11), однако взаимосвязь между гастрином, выделением желудочного сока и патологией желудка полностью не описана. Гастрин выделяется почками, и существует предположение, что с ухудшением функции почек развивается гипергастринемия, приводящая к гиперкислотности желудка (11). Однако у кошек с гастрин-секретирующими опухолями и с уровнями гипергастринемии, сопоставимыми с таковыми у кошек с ХБП, присутствуют выраженные патологии желудка; при этом у кошек с ХБП такие патологии выявлены не были (12). У человека при ХБП развитие гиперкислотности желудка, по-видимому, неустойчиво и может быть скорее связано с присутствием инфекции Helicobacter spp. В недавно проведенном исследовании по оценке типов и встречаемости гистопатологических очагов поражения желудка у кошек с ХБП основными выявленными патологиями были фиброз и минерализация желудка, а не патологии, связанные с уремической гастропатией, описанные ранее у собак и человека (азотемический гастрит, изъязвление, сосудистое повреждение, отек) (12). Уремические токсины регистрируются хеморецепторной триггерной зоной (ХРТЗ), расположенной в area postrema головного мозга, которая затем вызывает рвоту посредством стимуляции рвотного центра. Согласно проведенным исследованиям, подавление этой зоны позволяет прекратить уремическую рвоту у собак (13), следовательно, лекарственные препараты, направленные на рецепторы ХРТЗ (т. е. 5HT3 и NK1) могут оказаться полезными при контроле питания пациентов с ХБП. Помимо накопления уремических токсинов у кошек с ХБП могут наблюдаться значительные отклонения в общей физиологии регуляции аппетита. Механизм регуляции аппетита состоит из орексигенных веществ (например, грелин), активирующих центр голода, и анорексигенов (т. е. лептин, холецистокинин, обестатин, дезацилгрелин), активирующих центр насыщения в головном мозге (5). ХБП у человека связана с повышенным накоплением анорексигенов вследствие снижения скорости клубочковой фильтрации без сопутствующего повышения уровня орексигенных веществ. Помимо этого, было продемонстрировано, что уровень анорексигенов у пациентов с ХБП при низкой степени упитанности достоверно выше, чем у пациентов с нормальной оценкой BCS (5).
Как проводить оценку питания худой кошки с ХБП?
Периодическая оценка алиментарного статуса – ключевая составляющая ведения пациента с ХБП, и для каждого пациента следует разрабатывать план питания. Информация об этих параметрах и инструментах оценки была опубликована в рамках глобальной диетологической инициативы* Всемирной ассоциации ветеринарии мелких животных (WSAVA). Оценка питания должна включать показатели массы тела, балльную оценку упитанности (BCS) и мышечной массы, полную историю питания (включая используемый корм, лакомства, биологически активные добавки и продукты, используемые для приема лекарственных препаратов), а также заключение об общем уровне потребления калорий (в котором должны быть вопросы открытого типа о том, как кошка питается). Хотя BCS является незаменимым инструментом оценки состояния животных, у страдающих ожирением пациентов с недостаточной мышечной массой сама по себе оценка упитанности зачастую не позволяет адекватно отразить потерю мышечной ткани. Оценка мышечной массы особенно важна для пациентов с ХБП, поскольку может оказывать сильное влияние на сывороточный креатинин и влиять на оценку степени тяжести заболевания, а также иметь значительные последствия для алиментарного статуса. Балльная оценка мышечной массы может проводиться (Рисунок 4) на основе оценки мускулатуры в области спины, головы, лопаток, таза и регистрироваться в амбулаторной карте при каждом посещении.
.png)
Как контролировать питание у таких пациентов?
Выявление недостаточности питания — это огромный шаг в правильном направлении. Не следует оставлять без внимания острую и хроническую дисрексию при лечении кошек с ХБП, особенно учитывая их специфические потребности в питательных веществах. В случае острой формы заболевания у кошек с ХБП, у которых наблюдается недостаточное потребление корма в течение более 3-5 дней (включая время до приема в ветеринарной клинике), следует осуществлять нутритивную поддержку. Адекватная калорийная поддержка критически важна для эффективного восстановления при уремическом кризе и предотвращения значительного общего ухудшения состояния. При таком сценарии полезным неинвазивным вариантом для кошки с ХБП может стать временное питание через носопищеводный зонд (Рисунок 5). Было продемонстрировано, что специальные диеты для пациентов с заболеваниями почек могут оказывать благотворное действие на кошек с хронической формой ХБП (14), однако они могут не давать желаемого эффекта, если потребляется недостаточное количество калорий. Таким образом, ключевая терапевтическая цель для таких пациентов заключается в определении потребности в энергии и улучшении аппетита и потребления корма для удовлетворения этих потребностей, с последующим поддержанием упитанности и мышечной массы. Как отмечено выше, важно выявлять и контролировать осложнения заболеваний почек, способные повлиять на аппетит. Кроме того, при контроле питания может быть полезно использовать такие методы, как изменение типа и температуры корма, места кормления, применение усилителей вкуса и запаха и (в конечном итоге) стимуляторов аппетита (3). Если уровень потребления энергии все еще недостаточный, для долгосрочного контроля следует рассмотреть вариант применения пищеводного зонда (Рисунок 6) (15). Для поддержания мышечной массы и сил также крайне важны регулярные физические нагрузки.


Какие лекарственные препараты существуют против дисрексии и тошноты у кошек с ХБП?
Хотя сложно определить, когда пациенты с ХБП испытывают чувство тошноты, если у них не наблюдается активная рвота, эта область считается оправданной терапевтической целью. Существует ряд препаратов против рвоты/тошноты, которые могут быть полезны для нейтрализации тошноты и рвоты при ХБП. В их числе – антагонист рецепторов NK1 маропитанта цитрат и антагонисты рецепторов 5HT3 ондансетрон, доласетрон и миртазапин. Эти препараты воздействуют на рецепторы ХРТЗ и рвотного центра головного мозга, реагирующие на уремические токсины, а также на рецепторы в ЖКТ. Маропитант часто назначают краткосрочно при острой рвоте, хотя в одном исследовании было показано, что более длительное применение данного препарата, по всей видимости, безопасно для кошек, и он нередко применяется для длительной терапии пациентов с хронической формой заболевания (16). При ежедневном применении в течение двух недель в дозе 4 мг на кошку было показано, что маропитант временно ослабляет рвоту у кошек с ХБП 2-й и 3-й стадии (17). Вследствие выбора схемы плацебо-контролируемого исследования, кошки с 4-й стадией ХБП не принимали в нем участие, но следует отметить, что данный препарат чаще назначают именно этой группе пациентов.
Ондансетрон и доласетрон часто применяются в качестве противорвотных препаратов, однако недавние исследования поставили под вопрос их эффективность в текущих рекомендуемых дозах для кошек, поскольку пероральная биодоступность ондансетрона слабая (~35 %), а период полувыведения очень короткий (~1 ч), из-за чего применение препарата наиболее целесообразно каждые 8 часов (18). У формы ондансетрона для подкожного введения период полувыведения был несколько длиннее и составлял 3 часа. Ондансетрон также не следует применять трансдермально: в недавно опубликованном докладе по результатам оценки трансдермального всасывания препарата у кошек было показано отсутствие клинически значимых концентраций препарата в крови после его введения (19). Доласетрон традиционно рекомендуется в дозе 0,5–1 мг/кг один раз в сутки, однако в недавно опубликованном докладе было показано, что препарат не обнаруживается в сыворотке крови через 12 часов после подкожного введения в дозе 0,8 мг/кг и не облегчает ксилазин-индуцированную рвоту (20).
Миртазапин хотя и используется чаще в качестве стимулятора аппетита, также обладает противорвотными свойствами, воздействуя на рецепторы 5HT3. В нескольких исследованиях было описано успешное временное уменьшение тошноты и рвоты у человека, особенно у онкобольных, проходящих химиотерапию (21), а у кошек препарат достоверно уменьшает рвоту, связанную с ХБП (22).
В дополнение к контролю уремической тошноты и рвоты, для улучшения потребления корма могут применяться стимуляторы аппетита, в частности, если владелец не хочет использовать зонд для искусственного кормления. Применение таких препаратов лучше всего начинать сразу после того, как обнаружено нарушение аппетита и снижение мышечной массы, и когда энергетические потребности не удовлетворяются. Ципрогептадин уже применяется в течение некоторого времени и, согласно наблюдениям, эффективен для многих пациентов, однако научных исследований препарата не проводилось. Миртазапин стал чаще применяться в качестве мощного стимулятора аппетита у кошек, и в недавних исследованиях была получена информация по повышению эффективности применения препарата (22–24), хотя более высокие дозы чаще связаны с побочными эффектами (гипервозбудимость, вокализация, тремор) (25). Таким образом, для сохранения эффективности и минимизации побочных эффектов рекомендуется использование препарата в меньших, более частых дозировках: период полувыведения достаточно короткий для ежедневного введения здоровым кошкам (24), с рекомендуемой дозой 1,88 мг на кошку один раз в сутки. Болезнь почек замедляет клиренс (коэффициент очищения), поэтому для кошек с ХБП рекомендуется применение препарата через день (т. е. 1,88 мг раз в два дня) (23), при этом в недавно проведенных клинических испытаниях была продемонстрирована эффективность препарата в указанной дозе у кошек с ХБП: результатом стало достоверное улучшение аппетита и прирост массы тела (22) (Рисунок 7). Миртазапин также может применяться трансдермально: было показано, что у здоровых кошек достигается достаточный уровень препарата в сыворотке крови, и его применение вызывает стимуляцию аппетита, и хотя клинические исследования на кошках с ХБП еще предстоит провести, по результатам наблюдений начальные дозы для трансдермального (наружного) применения при болезни почек показали свою эффективность при 1,88–3,75 мг/0,1 мл геля раз в два дня.
Появление в будущем капроморелина, агониста грелина, также может дать дополнительные возможности контроля аппетита у кошек с ХБП посредством воздействия на патофизиологию регуляции аппетита. Существуют отчеты о том, что введение грелина приводит к улучшению аппетита и повышению потребления энергии у пациентов с ХБП, и в недавнем исследовании с участием кошек было показано, что введение капроморелина приводило к повышению потребления корма и приросту массы тела (26).
По некоторым свидетельствам, ограничение кислотности желудка с помощью блокаторов H2 гистаминовых рецепторов (например, фамотидин) или ингибиторов протонной помпы (например, омепразол) смягчает отсутствие аппетита у некоторых пациентов с ХБП. Однако данные препараты никогда не оценивались в ходе клинических исследований, несмотря на то, что фамотидин является одним из наиболее часто назначаемых препаратов для кошек с ХБП (2).
Недавно проведенные исследования воздействия омепразола на pH желудка у здоровых кошек указывают на то, что в дозе 1 мг/кг два раза в день он превосходит фамотидин по способности ингибирования кислотообразования (27), но и в этом случае клинических испытаний на кошках с ХБП не проводилось, и, как отмечалось ранее, в настоящее время степень гиперкислотности у кошек с ХБП неизвестна. Проблематичен тот факт, что недавно была выявлена связь ингибиторов протонной помпы с повышенным риском развития болезни почек у человека (28); применимость данных результатов к пациентам ветеринарных клиник абсолютно неизвестна.

-
1.Freeman L, Lachaud MP, Matthews S, et al. Evaluation of weight loss over time in cats with chronic kidney disease. J Vet Intern Med 2015;29:1272.
-
2.Markovich JE, Freeman LM, Labato MA, et al. Survey of dietary and medication practices of owners of cats with chronic kidney disease. J Feline Med Surg 2015;17:979-983.
-
3.Freeman LM. Cachexia and sarcopenia: emerging syndromes of importance in dogs and cats. J Vet Intern Med 2012;26:3-17.
-
4.Argiles JM, Busquets S, Stemmler B, et al. Cachexia and sarcopenia: mechanisms and potential targets for intervention. Curr Opin Pharmacol 2015;22:100-106.
-
5.Gunta SS, Mak RH. Ghrelin and leptin pathophysiology in chronic kidney disease. Pediatr Nephrol 2013;28:611-616.
-
6.Carrero JJ, Stenvinkel P, Cuppari L, et al. Etiology of the protein-energy wasting syndrome in chronic kidney disease: a consensus statement from the International Society of Renal Nutrition and Metabolism (ISRNM). J Renal Nutr 2013;23:77-90.
-
7.Neyra R, Chen KY, Sun M, et al. Increased resting energy expenditure in patients with end-stage renal disease. J Parenter Enteral Nutr 2003;27:36-42.
-
8.Laflamme DP. Nutrition for aging cats and dogs and the importance of body condition. Vet Clin North Am Small Anim Pract 2005;35:713-742.
-
9.Sparkes AH. Feeding old cats – an update on new nutritional therapies. Top Companion Anim Med 2011;26:37-42.
-
10.Bijsmans ES, Jepson RE, Syme HM, et al. Psychometric validation of a general health quality of life tool for cats used to compare healthy cats and cats with chronic kidney disease. J Vet Intern Med 2016;30:183-191.
-
11.Goldstein RE, Marks SL, Kass PH, et al. Gastrin concentrations in plasma of cats with chronic renal failure. J Am Vet Med Assoc 1998;213:826-828.
-
12.McLeland SM, Lunn KF, Duncan CG, et al. Relationship among serum creatinine, serum gastrin, calcium-phosphorus product, and uremic gastropathy in cats with chronic kidney disease. J Vet Intern Med 2014;28:827-837.
-
13.Borison HL, Hebertson LM. Role of medullary emetic chemoreceptor trigger zone (CT zone) in postnephrectomy vomiting in dogs. Am J Physiol 1959;197:850-852.
-
14.Ross SJ, Osborne CA, Kirk CA, et al. Clinical evaluation of dietary modification for treatment of spontaneous chronic kidney disease in cats. J Am Vet Med Assoc 2006;229:949-957.
-
15.Ross S. Utilization of feeding tubes in the management of feline chronic kidney disease. Vet Clin North Am Small Anim Pract 2016;46:1099-1114.
-
16.Hickman MA, Cox SR, Mahabir S, et al. Safety, pharmacokinetics and use of the novel NK-1 receptor antagonist maropitant (Cerenia) for the prevention of emesis and motion sickness in cats. J Vet Pharmacol Ther 2008;31:220-229.
-
17.Quimby JM, Brock WT, Moses K, et al. Chronic use of maropitant for the management of vomiting and inappetence in cats with chronic kidney disease: a blinded placebo-controlled clinical trial. J Feline Med Surg 2015;17:692-697.
-
18.Quimby JM, Lake RC, Hansen RJ, et al. Oral, subcutaneous, and intravenous pharmacokinetics of ondansetron in healthy cats. J Vet Pharmacol Ther 2014;37:348-353.
-
19.Zajic LB, Herndon A, Sieberg L, et al. Investigation of the pharmacokinetics of transdermal ondansetron in normal purpose-bred cats. J Feline Med Surg 2017. Jan 1. doi: 10.1177/1098612X16688807. [Epub ahead of print]
-
20.Herndon A, Sieberg L, Davis L, et al. Pharmacokinetics of intravenous and subcutaneous dolasetron and pharmacodynamics of subcutaneous dolasetron in purpose-bred cats. J Vet Intern Med 2016;30:90.
-
21.Kast RE, Foley KF. Cancer chemotherapy and cachexia: mirtazapine and olanzapine are 5-HT3 antagonists with good antinausea effects. Eur J Cancer Care (Engl) 2007;16:351-354.
-
22.Quimby JM, Lunn KF. Mirtazapine as an appetite stimulant and anti-emetic in cats with chronic kidney disease: a masked placebo-controlled crossover clinical trial. Vet J 2013;197:651-655.
-
23.Quimby JM, Gustafson DL, Lunn KF. The pharmacokinetics of mirtazapine in cats with chronic kidney disease and in age-matched control cats. J Vet Intern Med 2011;25:985-989.
-
24.Quimby JM, Gustafson DL, Samber BJ, et al. Studies on the pharmacokinetics and pharmacodynamics of mirtazapine in healthy young cats. J Vet Pharmacol Ther 2011;34:388-396.
-
25.Ferguson LE, McLean MK, Bates JA, et al. Mirtazapine toxicity in cats: retrospective study of 84 cases (2006-2011). J Feline Med Surg 2015.pii: 1098612X15599026. [Epub ahead of print]
-
26.Zollers B, Allen J, Kennedy C, et al. Capromorelin, an orally active ghrelin agonist, caused sustained increases in IGF-1, increased food intake and body weight in cats. J Vet Intern Med 2015;29:1219.
-
27.Parkinson S, Tolbert K, Messenger K, et al. Evaluation of the effect of orally administered acid suppressants on intragastric pH in cats. J Vet Intern Med 2015;29:104-112.
-
28.Lazarus B, Chen Y, Wilson FP, et al. Proton pump inhibitor use and the risk of chronic kidney disease. JAMA Intern Med 2016;176:238-246.




 4045
4045  25 мин
25 мин








