Введение
Кожа — удивительная анатомическая структура и самый большой орган тела. Она выполняет жизненно важную для организма барьерную функцию между внутренними органами и внешней средой, защищая его от чужеродных веществ и способствуя сохранению здоровья. В ходе эволюции эпидермис кожи стал динамичной структурой, способной гомеостатически реагировать на изменяющиеся условия внешней среды. В статье рассматривается роль кожного барьера при атопическом дерматите у собак (canine Atopic Dermatitis, сAD или АДс) и обсуждаются способы улучшения его здоровья.
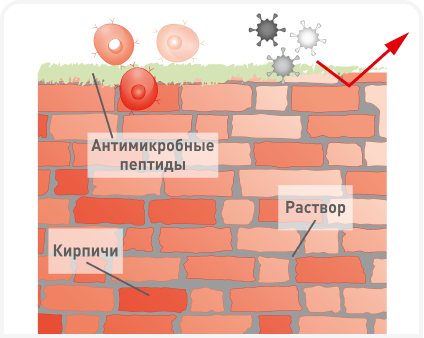
Эпидермальный слой кожи состоит из нескольких ярусов корнеоцитов, а именно (изнутри наружу): базального слоя (stratum basale), слоя шиповатых клеток (stratum spinosum), зернистого слоя (stratum granulosum) и рогового слоя (stratum corneum — SC). Корнеоцит образуется на конечном этапе ороговения эпидермиса; у собак обновление эпидермиса занимает около 22 дней. Происходящие из базального слоя новые клетки мигрируют вверх по эпидермису, заменяя внешний слой отмерших клеток. Клетки соединены липидным матриксом, содержащим холестерин, свободные жирные кислоты и церамиды, способствующие образованию внеклеточных пластинчатых мембран с высоким содержанием липидов. Обычно кожный барьер сравнивают с кирпичной стеной, где SC образует «кирпичи», а обогащенные липидами слои между клетками — «строительный раствор» (Рисунок 1а) (1). Для поддержания барьерной функции кожи важно сохранение целостности SC, особенно липидного матрикса. 5. Две картинки
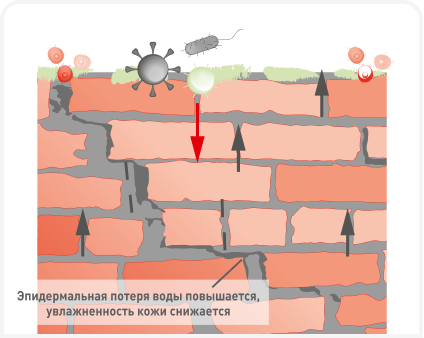
Помимо межклеточных липидов, самый внешний слой SC покрыт различными гидрофобными молекулами, образующими защитный барьер от микробов и аллергенов. Функция поверхности кожи и ее липидов при атопическом дерматите (АД) и у человека, и у собак хорошо изучена, и причиной нарушения целостности кожного барьера при АД считают изменения в составе липидов (свободных жирных кислот и церамидов) и структуре пластинчатых мембран кожи (Рисунок 1b) (2). Окончательно взаимосвязь дисфункции кожного барьера с развитием АДс пока не доказана, но выявлено несколько генов-кандидатов, связанных с нарушением целостности эпидермального барьера при АДс, например кодирующие белки экзоскелета плакофилин-2 (PKP2) и филаггрин (FLG) (3). В медицине человека для оценки барьерной функции кожи, эффективности лечения атопии и исследования косметических средств используют методы измерения гидратации кожи (skin hydration — SH) и чрескожной потери жидкости (transepidermal water loss — TEWL) (4). Измерения TEWL и SH часто включают в клинические испытания, поскольку это неинвазивные и удобные методы, но для использования у собак они не стандартизированы.
Кожа также заселена разнообразными микроорганизмами (бактериями и грибами рода Malassezia и др.), называемыми микробиотой. В последние годы развитие методов секвенирования нового поколения позволило идентифицировать широкий спектр обитателей кожи, и было выявлено, что в разных участках тела у одной и той же собаки микробиота может значительно различаться. Примечательно, что она восприимчива к воздействию ряда факторов, например к местной терапии, системным лекарственным препаратам (особенно противомикробным) и даже условиям окружающей среды.
При контакте в раннем возрасте с широким спектром микробиоты организм обучается лучше адаптироваться к безвредным микроорганизмам (5); у человека из этого наблюдения развилась гигиеническая гипотеза атопии. Она была предложена в 1989 году для объяснения растущей распространенности атопических состояний у человека; согласно этой гипотезе, более высокая частота развития детских инфекций может защитить организм от развития атопических заболеваний в дальнейшей жизни. Младенцы обычно рождаются с иммунным ответом с преобладанием Th-2 (Т-хелперных клеток); после рождения под влиянием микробиологического воздействия он может быстро отключаться, а при раннем воздействии аллергенов — усиливаться. Известно, что клетки Th2 участвуют в аллергических реакциях, а реакция Th1-клеток направлена в основном против возбудителей инфекций. В идеале эти два фактора должны находиться в равновесии; у младенцев со сбалансированным соотношением Th1/Th2 вероятность развития атопических заболеваний в дальнейшей жизни ниже. К сожалению, в настоящее время исследований, подтверждающих гигиеническую гипотезу АД у собак, нет, но выявлено меньшее разнообразие микробиома кожи у собак с атопией по сравнению со здоровыми собаками, имеющими очень разнообразную микробиоту (6). Кроме того, при обострениях АД у собак временно нарушается равновесие микробиоты (развивается дисбиоз) из‑за существенного увеличения количества Staphylococcus spp. Однако после антимикробной терапии и во время ремиссии поражений TEWL снижается, а микробное разнообразие восстанавливается (7).
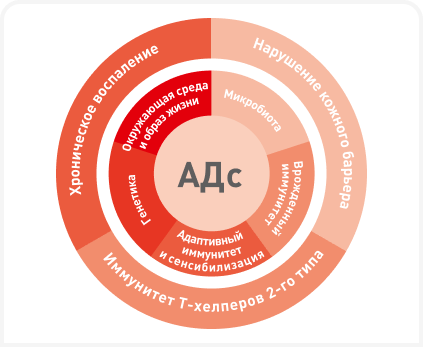
АДс — сопровождающееся зудом воспалительное заболевание кожи, развивающееся преимущественно под действием Т-клеток. Его патогенез многофакторный, включающий сложное взаимодействие нарушения иммунной регуляции, дисфункции кожного барьера, генетической предрасположенности, факторов окружающей среды и дисбиоза (Рисунок 2). Предполагается, что значительную роль в развитии АДс играют факторы окружающей среды (3), поскольку образ жизни собаки, особенно щенка, значительно влияет на созревание иммунной системы. Таким образом, у собак, выросших в сельской местности, в большой семье и в контакте с другими животными, риск развития АДс в более позднем возрасте может быть ниже. Кроме того, получены также данные о защитном действии инфекции Toxocara canis от развития АДс, вызванного Dermatophagoides farina (клещ домашней пыли) (3).
Анатомия эпидермиса
Микробиота кожи
Атопический дерматит у собак
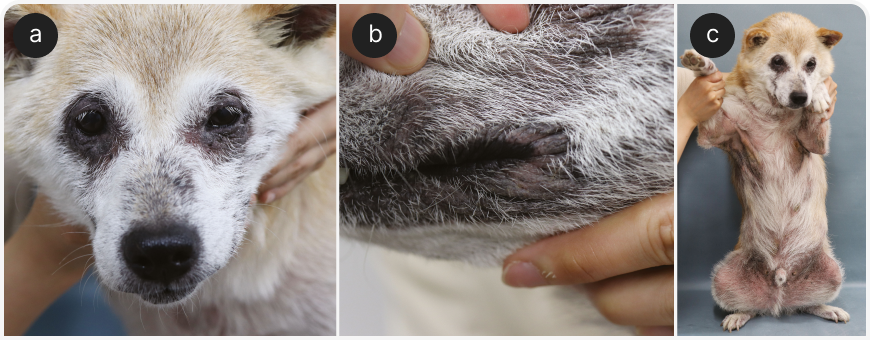
Основной клинический признак АДс — зуд, который может быть как сезонным, так и несезонным. Поражения обычно появляются в окологлазной области, на морде, в подмышечных впадинах, паховой и перианальной областях и на конечностях (Рисунок 3). АДс у собак может приводить к рецидивам наружного отита и пододерматита, часто сопровождающимся вторичными бактериальными инфекциями или разрастанием микроорганизмов рода Malassezia. Диагностируют АДс путем исключения других кожных зудящих заболеваний, особенно напоминающих АДс, таких как инвазия блох / гиперчувствительность к укусам блох, чесотка, нежелательная пищевая реакция (НПР).

После последовательного проведения обработки от эктопаразитов, диагностических обследований и элиминационной диеты для установления клинического диагноза АДс используют критерии Фавро (Таблица 1) (8). Для выявления связанных с АДс аллергенов проводят кожные пробы и серологические тесты на IgE, хотя следует понимать, что эти тесты необходимы, только если планируется проведение аллергенспецифической иммунотерапии (9).
Осложняющие факторы — пиодермия
Staphylococcus pseudintermedius, один из комменсалов на коже собак и условно патогенный микроорганизм при пиодермии и наружном отите, часто ассоциируется с АДс и/или нежелательной пищевой реакцией (10). В здоровой коже действуют внутренние защитные механизмы для предотвращения чрезмерного роста бактерий, такие как антимикробные пептиды, бета-дефензины и кателицидины, расположенные во внеклеточных пространствах кожи (11). Микробиота и кожный барьер совместно поддерживают целостность кожи и защищают ее от воздействия факторов внешней среды.
Факторы, способствующие повышенной восприимчивости собак с АД к инфекциям Staphylococcus spp., до конца не выяснены. Бактериальную инфекцию кожи (поверхностный фолликулит и пиодермию) диагностируют на основе клинической картины (папулы, пустулы или эпидермальные воротнички — Рисунок 4) и выявления при цитологическом исследовании внутриклеточных кокков. Для лечения вторичных бактериальных инфекций эффективна местная терапия. При АДс особенно полезно купать собаку с использованием шампуня, поскольку поддержание гигиены кожи и шерсти способствует укреплению здоровья кожного барьера. Купание с шампунем уменьшает количество аллергенов, прикрепленных к поверхности кожи или шерстному покрову, и предотвращает дальнейшее раздражение кожи. Более того, в исследованиях in vitro было показано, что остаточная эффективность шампуней или муссов с антисептическими ингредиентами сохранялась до 14 дней (12), поэтому при лечении поверхностной пиодермии могут быть полезны средства, содержащие хлоргексидин, бензоилпероксид, этиллактат, повидон-йод или триклозан (13). Их следует использовать 2–3 раза в неделю, а после разрешения поражений уменьшить частоту применения до одного раза в неделю (13). Кроме того, в качестве местных антимикробных средств показаны мупироцин и фузидиевая кислота, реже вызывающие рост S. pseudomonas с множественной лекарственной устойчивостью (MRSP). Системную антимикробную терапию следует рассматривать только в том случае, если местное лечение оказалось неэффективным или если глубина и локализация инфекции выходят за рамки возможностей местной терапии; антибиотики при этом подбирают по результатам исследования чувствительности возбудителей. Как правило, после того как поражения проходят, курс лечения продолжают еще 2 недели. Однако в связи с глобальным распространением MRSP настоятельно рекомендуется, если позволяет состояние пациента, отдавать предпочтение не повторной системной антимикробной терапии, а местному лечению.
.png)
Эксперт-квиз по диагностике зуда
Осложняющие факторы — Malassezia
Malassezia pachydermatis — это липидзависимые дрожжевые грибки, обнаруживаемые на поверхности кожи. Чрезмерному росту этого условно патогенного микроорганизма при АДс могут способствовать избыток поверхностных липидов, нарушения барьерной функции SC и патологическая иммунная реакция (14). Он колонизирует кожу щенков аналогично Staphylococcus spp., передаваясь от суки на самых ранних сроках жизни при вылизывании и кормлении молоком. При благоприятных условиях Malassezia может размножаться внутри SC, выделяя множество антигенов и аллергенов (14). Эти антигены могут проникать в эпидермис и вызывать у собак с АДс иммунный ответ, проявляющийся зудом и эритемой. Malassezia активно растет на участках кожи с высокой влажностью, таких как кожные складки вокруг ушей, губ, заднего прохода, подмышечных впадин, паховой области и когтей / межпальцевых областей. Клинически этот рост может проявляться зудом и эритемой, сопровождающимися неприятным запахом или жирностью кожи. Золотого стандарта для диагностики малассезиозного дерматита не существует, но наиболее эффективными методами считают цитологическое исследование кожи и соответствующую диагнозу клиническую картину; культуральные, гистопатологические и IgE-тесты для клинической диагностики малоэффективны.
Основные методы лечения — противогрибковые средства: имидазолы для местного применения, клотримазол, климбазол, миконазол. Альтернативы: тербинафин и 2%-ный хлоргексидин / шампунь с 2%-ным миконазолом. Однако, хотя антисептические ингредиенты могут существенно уменьшить чрезмерный рост Malassezia, клинически не менее эффективны смягчающие средства для купания, содержащие очищающие масла, и смягчающие шампуни с увлажняющим кремом на основе церамидов (15).
Осложняющие факторы — блохи и нежелательная пищевая реакция
При лечении АДс крайне важны борьба с блохами и устранение пищевых аллергенов, поскольку это помогает снизить вероятность зуда и тем самым повысить качество жизни пациента. Для эффективной круглогодичной борьбы с блохами применяют пероральные инсектициды, убивающие только взрослых насекомых, поскольку купание с шампунем может смыть с кожи и шерсти средства для местного применения и снизить их эффективность. Действие препаратов с изоксазолином начинается быстро, в течение 24 часов, что предотвращает дальнейшие укусы блох.
АДс может сочетаться с нежелательными пищевыми реакциями, согласно оценкам, с частотой от 9 до 50%. Чтобы дифференцировать НПР и атопический дерматит (который в основном обусловлен аллергенами окружающей среды), необходимо соблюдение на протяжении восьми недель строгой элиминационной диеты с новым или гидролизованным белком. После проведения такой диеты желательно также рассмотреть возможность провокационного кормления, чтобы выявить специфические пищевые аллергены и впоследствии исключить их из ежедневного рациона собаки. Хотя иммунный механизм развития НПР до конца не изучен, в исследовании в ходе пробной элиминационной диеты было выявлено значительное клиническое улучшение, которое при последующем возобновлении кормления вызвавшим реакцию кормом у 90% собак сменилось возобновлением клинических проявлений (зуда, вылизывания лап, потирания морды), причем у некоторых животных эти симптомы появились уже через несколько часов после провокационного кормления (16).
АДс — кожное заболевание, которое невозможно полностью вылечить, лечение обычно длится на протяжении всей жизни и должно быть адаптировано к особенностям каждого пациента. Специфическим лечением считают аллерген-специфическую иммунотерапию (АСИТ), при которой проводят инъекции возрастающих концентраций внешних аллергенов, выявленных при кожном тестировании и серологическом определении IgE. Клиническая эффективность АСИТ составляет приблизительно 60%, и для достижения заметного улучшения может потребоваться 9–12 месяцев лечения (17). Недавно в качестве альтернативы традиционному методу подкожных инъекций были предложены варианты внутрилимфатической и сублингвальной иммунотерапии; они обеспечивают более быструю индукцию, а для первой не требуется использование игл (18). Однако до тех пор, пока АСИТ не приведет к купированию клинических проявлений, важно непрерывно продолжать терапию зуда и поражений кожи. Лечение разных стадий заболевания АДс различается; например, при острых вспышках требуется быстрое вмешательство, хроническое заболевание нужно контролировать, а рецидивы предотвращать с помощью профилактических мер. Поскольку зуд является ключевым признаком АД, а поражения кожи часто развиваются вторично, лечение должно быть направлено на уменьшение зуда. Местное и/или системное медикаментозное лечение выбирают в зависимости от интенсивности зуда, а также от распределения и площади поражений. Для борьбы с острыми вспышками наиболее эффективны глюкокортикоиды (местные и системные) и оклацитиниб, поскольку они действуют быстро; однако глюкокортикоидам свойственны нежелательные эффекты, включая полиурию, полидипсию, полифагию, повышенную восприимчивость к инфекциям, ятрогенный гиперадренокортицизм. При длительном применении или высоких дозах глюкокортикоидов за пациентом следует тщательно наблюдать и по возможности переходить на другие режимы лечения. Когда кожные поражения уменьшаются до легких, предпочтителен оклацитиниб, эффективный для лечения остаточного зуда и легких вспышек, поскольку он уменьшает зудогенный сигнальный путь и уровень провоспалительных цитокинов. Однако при переходе к получению терапии один раз в день после начальной двухнедельной фазы приема два раза в день у пациентов часто наблюдается возобновление симптомов (феномен рикошета) (19). Чтобы предотвратить такой рикошет, к комбинированной терапии можно добавить местный препарат гидрокортизона ацепоната (20).
Эти режимы можно считать симптоматическими, в первую очередь для лечения развивающихся вспышек или для купирования зуда. Как только состояние кожи будет стабилизировано, следует перевести животное на узконаправленные препараты с меньшим числом нежелательных эффектов; как правило, это циклоспорин и такролимус. Циклоспорин ингибирует кальциневрин, который связывается с цитоплазмой лимфоцитов, ингибируя активацию Т-клеток и выделение медиаторов. Тем не менее клинический эффект развивается через 2–4 недели после введения циклоспорина, но из‑за длительного периода полувыведения чаще, по сравнению с другими лекарственными препаратами, удается снизить частоту приема. Препарат считают безопасным при длительном применении, первоначально могут развиться преходящие нежелательные эффекты, такие как рвота и диарея; они обычно купируются самопроизвольно без лечения. Мазь такролимуса не вызывает нежелательных реакций (например, атрофии кожи или образования комедонов), наблюдаемых при местном применении глюкокортикоидов, но у некоторых собак может развиться легкое раздражение кожи. При хорошем контроле заболевания в качестве проактивной терапии рекомендуют применять локиветмаб (моноклональное антитело к интерлейкину (IL)-31, распространенному медиатору зуда при АДс) (21). Идея заключается в последовательном уменьшении остаточного субклинического воспаления, которое потенциально может спровоцировать внезапные вспышки заболевания.
Еще один важный фактор предотвращения рецидива АДс — прямое восстановление барьерной функции кожи; много лет для этого назначают незаменимые жирные кислоты (НЖК) внутрь или диеты, обогащенные жирными кислотами. Показано, что при АДс прием НЖК в течение 9 месяцев снижает уровень лекарственной терапии и зуд (22), но доказательных данных в поддержку использования антигистаминных препаратов и пробиотиков для лечения АДс недостаточно.
Атопический дерматит собак (АДс) — хроническое рецидивирующее кожное заболевание, проявляющееся зудом и часто встречающееся в ветеринарной практике. Патогенез связан с нарушением целостности кожного барьера; в него вовлечены гены, ассоциированные с формированием дефекта в роговом слое, микробиота и влияющие на иммунный баланс факторы окружающей среды. За последнее десятилетие схемы и стратегии лечения АДс были значительно усовершенствованы, но первым шагом в ведении пациента с АДс остается правильная диагностика. Эффективность лечения может снизиться при сопутствующей бактериальной и/или дрожжевой инфекции, и в итоге терапию подбирают согласно фазе и тяжести клинического состояния. Хотя атопический дерматит неизлечим, мультимодальный подход позволяет обеспечить собаке хорошее качество жизни, а формирование здорового кожного барьера должно предотвратить дальнейшие обострения зуда и воспаления. Контроль и ведение пациентов с АДс

Заключение


телефона ниже для сброса пароля.



на номер
+7 {{ formatted_phone }}


Вы успешно прошли тест!
{{ formatted_phone }}.
Введите последние четыре цифры номера входящего звонка.

весь модуль
всех видеоуроков модуля














 428
428  10 мин
10 мин



.png)




