Введение
Атопический дерматит собак (CAD) — распространенное аллергическое заболевание кожи, которое развивается под воздействием преимущественно аллергенов окружающей среды, таких как клещи домашней пыли и пыльца трав, деревьев и сорняков. Этиология считается многофакторной, включающей дисфункцию эпидермального барьера в сочетании с нарушением регуляции иммунной системы, что приводит к развитию клинических симптомов на фоне предполагаемой генетической предрасположенности. В большинстве случаев заболевание начинается в молодом возрасте, но причиняет дискомфорт, вызываемый дерматитом и зудом, на протяжении всей жизни.
В этой статье рассматривается практический подход к лечению атопического дерматита собак. Задача ветеринарного специалиста состоит не только в том, чтобы успешно лечить пациента, но и в том, чтобы избегать тяжелых обострений аллергии. По этой причине лечение CAD требует от врача мультимодального подхода (Рисунок 1). Ремиссия достигается только при комбинации методов контроля за симптомами и предотвращения обострений, а варианты лечения зависят от индивидуальных особенностей пациента и тяжести заболевания.
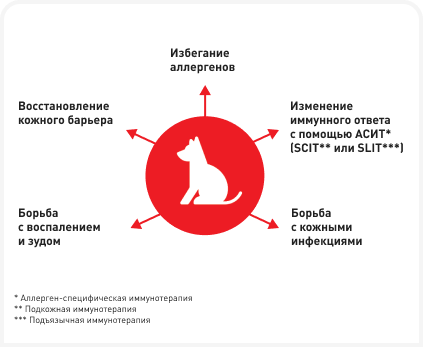
Исключение аллергенов
Поскольку наиболее распространенными аллергенами являются гликопротеины клещей домашней пыли и аэроаллергены, такие как пыльца, полностью предотвратить контакт с аллергеном трудно или невозможно. В неконтролируемом исследовании с целью уменьшить количество аллергенов пылевого клеща в окружающей среде распыляли акарицидный спрей, содержащий бензилбензоат, при этом были отмечены некоторые клинические улучшения у собак с атопией (1). Другие спреи для окружающей среды, представленные в настоящее время на рынке, содержат пробиотики, вырабатывающие ферменты, расщепляющие фекальные белки клещей домашней пыли. Для уточнения корреляции клинического улучшения у животных с атопией и уменьшения количества аллергенов пылевых клещей при использовании этих спреев необходимы дальнейшие контролируемые исследования.
Кроме того, по всей вероятности, использование лежаков без пылевых клещей, регулярная уборка пылесосом и стирка подстилок при температуре 60°C также снижают воздействие аллергенов клещей домашней пыли на кожу собак. В редких случаях питомцы с атопическим дерматитом могут реагировать на эпителий других содержащихся в семье домашних животных (например, попугая или морской свинки). В такой ситуации рекомендуется найти одному из питомцев другую семью. При сочетанном пищевом и атопическом дерматите причиной аллергии являются как пищевые компоненты, так и вещества окружающей среды (2). Пищевые аллергены могут иметь особенное значение в периоды обострений, поэтому для животных с атопическим дерматитом очень важно проведение элиминационной диеты и провокационных проб. Если доказана роль конкретного пищевого компонента в возникновении аллергической реакции, то несложно устранить провоцирующий фактор.
Восстановление функции кожного барьера
У собак, страдающих атопическим дерматитом, нарушен эпидермальный барьер, что приводит к повышенной трансэпидермальной потере воды (TEWL). У собак некоторых пород кожа может быть сухой и шелушащейся (ксероз). Увеличить способность эпидермиса удерживать влагу позволяет поддержка эпидермального барьера с помощью местных увлажняющих средств, таких как глицерин, пропиленгликоль, пантенол и мочевина, особенно при использовании после купания. Недавно эффективность такого лечения была продемонстрирована на модели хронического нарушения эпидермального барьера у собаки (3). Также улучшению состояния кожного барьера и снижению зуда и колонизации эпидермиса микроорганизмами способствуют продукты, содержащие фитосфингозин и офитриум — натуральный ингредиент, получаемый из корня ландышника (офиопогон японский) (4).
У питомцев с атопическим дерматитом также нарушаются межклеточные липидные пластинки (ламеллы) рогового слоя кожи. Для их восстановления применяют незаменимые жирные кислоты (НЖК) в виде пищевых добавок либо в составе корма, результаты при этом разнятся. Представляет интерес одно исследование хорошего качества, показавшее значительное снижение требуемой для достижения эффекта дозы преднизолона у собак с атопическим дерматитом при пероральном приеме НЖК на протяжении 12 недель (5). В качестве альтернативы можно использовать полнорационный корм, содержащий компоненты, поддерживающие здоровье кожного барьера. Также доказана эффективность НЖК в форме капель spot-on (6), хотя этот вариант лечения может быть более дорогостоящим. При CAD также были изучены другие препараты местного применения, включая шампуни, спреи и лосьоны, содержащие жирные кислоты и керамиды. К сожалению, эффективность этих средств оказалась противоречивой, однако ветеринарному врачу следует помнить, что восстановление эпидермального барьера, возможно, уменьшает степень проникновения аллергенов из окружающей среды.
Борьба с вторичными инфекциями кожи
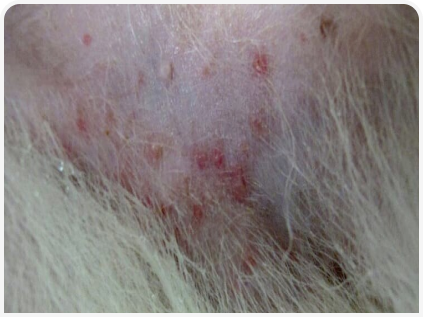
Распространенным симптомом атопического дерматита является рецидивирующая поверхностная пиодерма, при этом часто наблюдаются папулы, пустулы, «воротнички», корки и себорея (Рисунок 2). Колонизация кожи патогенными стафилококками (обычно S. pseudintermedius) при атопии по сравнению со здоровой кожей увеличивается, что может частично объясняться снижением антимикробной активности кожных антимикробных пептидов врожденного иммунитета. Во время обострений аллергии развивается дисбиоз микробиоты атопической кожи с относительным повышением уровня стафилококков. Этот дисбиоз купируется при помощи антимикробной терапии и во время ремиссии (7).
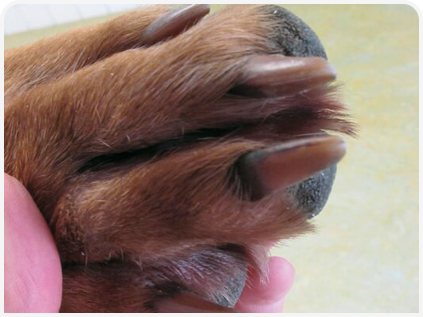
Примерно у 40% собак с атопическим дерматитом наблюдаются рецидивирующие инфекции кожи, вызванные дрожжевой инфекцией Malassezia pachydermatis, при этом часто отмечаются сильный запах, сальность кожи, пористая короста, корки и паронихия с окрашиванием когтей в коричневый цвет (Рисунок 3). Также может развиться реакция гиперчувствительности I типа на Malassezia, приводящая к сильному зуду (8).
Поэтому для лечения вторичных инфекций кожи, вызванных бактериями и дрожжами, всегда требуется антимикробная терапия. Часто для контроля заболевания достаточно местной терапии (шампуни, муссы, спреи, салфетки, гели). Показано, что шампунь с 3%-ным содержанием хлоргексидина клинически не менее эффективен в отношении бактерий и дрожжей, чем 2%-ный раствор хлоргексидина и комбинированный препарат с миконазолом (9). Обычно эффективно их применение два раза в неделю, но (в зависимости от тяжести инфекции) вначале местную терапию проводят чаще. Автор назначает ежедневное мытье в течение недели, затем неделю — через день, затем — два раза в неделю. По-видимому, не менее эффективны протоколы, включающие нанесение на очаги поражения в дополнение к еженедельному мытью шампунем дважды в неделю мусса, геля или спрея.
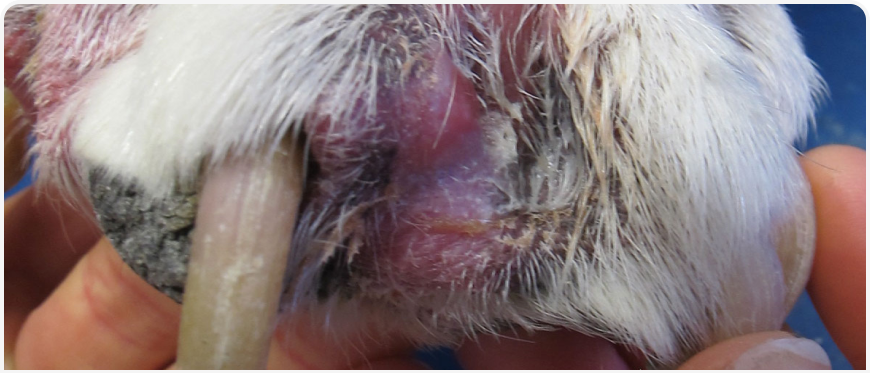
Системные антибиотики следует применять только в случаях глубокой пиодермии (например, при фурункулезе (Рисунок 4), выраженной генерализации или если владелец не справляется с применением препаратов местного действия. Ветеринарные врачи подбирают антимикробные препараты либо на основании данных посева на чувствительность к антибиотикам, либо на основании базовых принципов антибиотикотерапии; варианты лечения включают клиндамицин (10 мг/ кг каждые 12 ч), цефалоспорины (цефалексин 10- 30 мг/кг каждые 8-12 ч) или амоксициллин, потенцированный клавулановой кислотой (12,5 мг/кг каждые 12 ч). Лечение всегда проводят до исчезновения клинических проявлений и цитологических признаков пиодермии. Из-за риска развития резистентности бактерий следует избегать повторного применения антибиотиков.
Аналогичным образом, пероральное лечение кетоконазолом (10 мг/кг каждые 24 ч или 5 мг/кг каждые 12 ч) или итраконазолом (5 мг/кг каждые 24 ч) при дрожжевой инфекции следует назначать только в очень тяжелых случаях, поскольку дрожжи могут (редко) стать устойчивыми к производным азола (10). Однако помните, что (особенно с кетоконазолом) возможны различные нежелательные лекарственные взаимодействия.

Однако помните, что (особенно с кетоконазолом) возможны различные нежелательные лекарственные взаимодействия.
Эксперт-квиз по диагностике зуда
Борьба с воспалением кожи и зудом
Симптоматическая терапия, обладающая доказанной эффективностью для уменьшения зуда и степени выраженности атопического дерматита, включает глюкокортикостероиды, циклоспорин, оклацитиниб и локиветмаб; рассмотрим их последовательно. Обратите внимание, что для снижения порога ощущения зуда всегда необходима профилактическая обработка от блох. Убедительных доказательств эффективности лечения острых или хронических высыпаний при CAD пероральными антигистаминными препаратами первого поколения нет (11), но при необходимости их применения наиболее эффективными являются цетиризин (0,5-1,0 мг/кг каждые 24 ч) или гидроксизин (2 мг/кг каждые 12 ч) (12).
Глюкокортикостероиды
Глюкокортикостероиды (ГК) действуют путем влияния на множество широко представленных в организме факторов транскрипции, подавляя активность генов, кодирующих цитокины, рецепторы цитокинов, молекулы адгезии, провоспалительные ферменты и хемотаксические белки. Таким образом, они деактивируют многие воспалительные клетки и уменьшают зуд, а поскольку они действуют быстро, их можно использовать как для индуцирования ремиссии острых проявлений, так и для поддержания длительного контроля течения CAD. Однако, поскольку они воздействуют на множество различных клеточных механизмов, при длительном системном применении часто развиваются побочные эффекты: полиурия, полидипсия, полифагия, атрофия мышц и кожи, восприимчивость к бактериальным и грибковым инфекциям, демодекоз и ятрогенный гиперадренокортицизм (Рисунок 5).
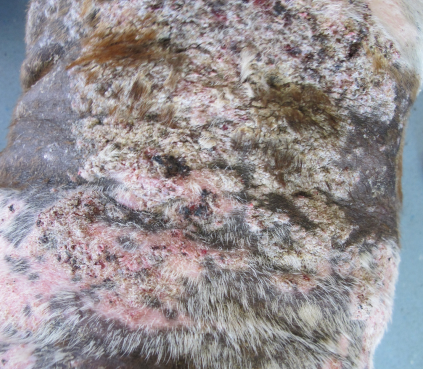
Поэтому парентеральные препараты не следует вводить многократно, но при выраженных клинических признаках рекомендуется использовать глюкокортикоиды короткого действия. Преднизолон внутрь (0,5- 1 мг/ кг каждые 24 ч) или метилпреднизолон (0,4-0,8 мг/кг каждые 24 ч) следует назначать в течение 5-14 дней, в зависимости от реакции пациента на лечение. Разделение дневной дозы на два приема может в некоторых случаях уменьшить полидипсию и полиурию. Затем дозу можно медленно снижать и давать препарат через день по мере уменьшения клинических признаков.
Предпочтительные лекарственные формы ГК: мазь для местного применения, спрей или лосьон. Спреи с триамцинолона ацетонидом и гидрокортизона ацепонатом обладают высокой эффективностью в достижении контроля над локализованными поражениями (13); до достижения ремиссии их следует использовать ежедневно в течение примерно двух недель, а затем продолжать наносить на отдельные поражения два раза в неделю. Гидрокортизона ацепонат потенциально может вызывать легкое истончение дермы, ингибируя пропептиды коллагена I и III, но в одном исследовании было показано отсутствие видимой атрофии кожи при длительном периодическом (дважды в неделю) местном применении препарата по поводу CAD (14). Человеческие препараты, такие как кремы с бетаметазоном или мометазона фуроатом, также оказались эффективны в ветеринарной практике. Конечной целью поддерживающего лечения местными ГК является активное снижение риска возникновения обострений заболевания и продление периода ремиссии, а не лечение только клинически видимых симптомов (14).
Оклацитиниб
Оклацитиниб — ветеринарный препарат, ингибитор янус-киназы (JAK). Янус-киназы — это нерецепторные тирозинкиназы, активируемые различными рецепторами цитокинов. У млекопитающих существует четыре семейства JAK (JAK1, JAK2, JAK3 и тирозинкиназа-2), регулирующие экспрессию множества генов воспаления. Селективно ингибируя JAK1- (и в минимальной степени JAK2-) зависимые цитокины, оклацитиниб может уменьшать действие провоспалительных и проаллергических цитокинов, поэтому считается, что его механизм действия при CAD полуширокого спектра.
Препарат быстро облегчает зуд, поэтому очень полезен для купирования его обострений. Его назначают дважды в день в течение 14 дней, а затем продолжают принимать один раз в день (0,4-0,6 мг/кг). Двухразовое применение препарата особенно важно при наличии хронического дерматита. Препарат считается безопасным для длительного лечения CAD у животных в возрасте 12 месяцев и более (15). Теоретически оклацитиниб при использовании в дозах, превышающих рекомендуемые, может обладать иммуносупрессивным действием (16), а его применение у предрасположенных животных может привести к развитию оппортунистических инфекций, вирусных папиллом или демодекоза. В таких случаях терапию следует прекратить, но в целом у собак при терапии оклацитинибом рутинное проведение гематологических исследований, биохимических анализов сыворотки крови и посевов мочи не показано (17).
Циклоспорин и такролимус
Циклоспорин А – ингибитор кальциневрина, обладающий специфическим иммуносупрессивным действием. Он связывается с внутриклеточными иммунофилинами, в результате чего ингибируется цитокин интерлейкин-2 (IL-2), что приводит к снижению пролиферации Т-клеток и выработки антител В-клетками, зависимыми от Т-хелперов. Циклоспорин также обладает механизмом действия широкого спектра и должен дозироваться по 5 мг/кг каждые 24 ч. Однако эффективность препарата развивается медленно; может пройти 4-8 недель, прежде чем клинические симптомы зуда и дерматита достигнут ремиссии, поэтому при CAD его можно использовать только для поддерживающей терапии. Одновременное лечение другими быстродействующими препаратами в начальной фазе признано эффективным и безопасным. В первые три недели лечения циклоспорином можно назначать преднизолон в дозировке 1 мг/ кг каждые 24 ч в течение недели, а затем продолжать прием каждые два дня в течение двух недель (18). Аналогичным образом, хорошо переносится одновременное назначение оклацитиниба (0,4-0,6 мг/кг каждые 12 ч) в течение 14 дней, затем один раз в день в течение семи дней (17). После достижения ремиссии дозу циклоспорина постепенно снижают (примерно до 1 мг/кг каждые две недели) или дают препарат через день, чтобы определить самый низкий из возможных режимов дозирования. Желудочно-кишечные побочные эффекты (рвота и диарея) развиваются у 30% пациентов, преимущественно в течение первой недели применения препарата. Некоторые ветеринарные специалисты у питомцев с чувствительным пищеварением используют в начале лечения более низкую дозу (например, 1,5 мг/кг каждые 24 ч в течение трех дней, затем 3 мг/кг каждые 24 ч в течение еще трех дней). Дача препарата с кормом также может снизить вероятность желудочно-кишечных осложнений. Менее частые побочные эффекты, которые могут быть дозозависимыми, включают гиперплазию десен, чрезмерный рост шерсти (Рисунок 6), восприимчивость к оппортунистическим (грибковым) инфекциям, гиперпластические веррукозные поражения и псориазиформно-лихеноидный дерматит. Однако эти побочные эффекты обычно регрессируют при прекращении приема препарата.
Установлено, что ингибитор кальциневрина такролимус при местном применении в течение нескольких недель уменьшает количество поражений (19). Хотя такролимус может раздражать кожу в первые дни лечения, применение препарата в концентрации 0,1% дважды в день, по-видимому, переносится собаками хорошо.

Локиветмаб
Локиветмаб – это ветеринарный препарат, моноклональное антитело против интерлейкина-31 собак. IL-31– цитокин, участвующий в развитии зуда. Механизм действия препарата отличается от механизма действия оклацитиниба; локиветмаб связывает IL- 31 еще до того, как тот сможет связаться с рецептором, и тем самым предотвращает основные вызывающие зуд свойства этого цитокина. Это наиболее специфическое симптоматическое средство для лечения атопии у собак.
Ежемесячные подкожные инъекции локиветмаба назначают в дозе 1-2 мг/ кг (в зависимости от регуляторных лицензионных данных), причем некоторые животные хорошо реагируют на более высокую дозу, что обычно позволяет достичь ремиссии продолжительностью 4-8 недель. Препарат имеет очень длительный период полувыведения и может безопасно использоваться с другими препаратами для симптоматической терапии CAD.
По эффективности в снижении зуда и количества поражений кожи (по визуально-аналоговой шкале зуда – PVAS и индексу степени и тяжести атопического дерматита у собак — CADESI, соответственно) после 28 дней лечения локиветмаб не уступает циклоспорину.
Хотя первоначальный ответ на локиветмаб проявляется быстро (снижение PVAS более чем на 50% достигается у 77% собак с атопическим дерматитом), его общая эффективность после девяти месяцев лечения была отмечена на уровне 59% (20). Препарат имеет минимум побочных эффектов, подходит для лечения животных с легким и умеренным зудом. На локиветмаб могут хорошо реагировать некоторые питомцы с недостаточным ответом на оклацитиниб. Однако он менее эффективен для лечения собак с атопическим дерматитом, проявляющейся тяжелыми (хроническими) поражениями, и, хотя он считается быстродействующим и безопасным при CAD, многие владельцы не готовы использовать его в качестве поддерживающей терапии из-за высокой стоимости.
Аллерген-специфическая иммунотерапия
Изменение иммунного ответа с помощью аллерген-специфической иммунотерапии (АСИТ) - единственный метод терапии, модифицирующий течение заболевания, нейтрализующий гиперреактивность иммунной системы и вызывающий иммунологическую толерантность. АСИТ можно определить, как метод «постепенного введения аллергенного экстракта в возрастающих количествах субъекту с аллергией для ослабления признаков, связанных с последующим воздействием причинного аллергена». Механизм действия метода включает индукцию аллерген-специфических регуляторных Т-клеток и выделяемого ими цитокина IL-10, индукцию уровня аллерген-специфического IgG4 и снижение соотношения цитокинов Th2/Th1 и уровня аллерген-специфического IgE (21). Основным методом АСИТ с начала 1980-х годов является подкожная иммунотерапия (SCIT). Для собак доступны два состава, а именно водный раствор и раствор на основе квасцов, и при соблюдении надлежащих протоколов лечения системные побочные эффекты наблюдаются редко. Для повышения эффективности или в определенные периоды (например, при сезонных колебаниях) конкретному пациенту часто требуется корректировка этих протоколов. Например, если у животного за неделю до повторного введения препарата возникают обострения, интервал между инъекциями должен быть сокращен, а если пациент реагирует усилением зуда после каждой инъекции, может потребоваться более низкая доза.
В предыдущих исследованиях у собак, страдающих атопическим дерматитом, общий процент успешного применения SCIT составил 50-70% после 9-12 месяцев лечения (22). Были предприняты попытки повысить эффективность и сократить время наступления клинической эффективности путем использования экспресс-протокола, и исследования на собаках с атопическим дерматитом показали, что этот метод безопасен и эффективен (23).
Автор рекомендует использовать SCIT только специалистам, работающим в узкоспециализированных ветеринарных центрах. Альтернативой SCIT является сублингвальная иммунотерапия (SLIT), при которой определенная доза аллергена вводится перорально один или два раза в день. Для этого необходимо активное участие владельца, так как животное не должно получать пищу или воду в течение 10 минут до и после применения препарата. В немногочисленных неконтролируемых открытых исследованиях не получено убедительных доказательств в пользу большей эффективности SLIT по сравнению с SCIT (24).
Интересен новый метод интралимфатической иммунотерапии (ILIT), при котором ожидается более быстрый и продолжительный по времени клинический эффект. (25). Независимо от вида АСИТ, необходима симптоматическая терапия для борьбы с воспалением кожи и зудом, пока не разовьется лечебный эффект иммунотерапии.
Заключение
Атопический дерматит – это хроническое заболевание кожи. Собакам с атопией требуется долгосрочное мультимодальное лечение с целью обеспечения хорошего качества жизни. Для достижения наилучших результатов лечения необходимо сотрудничество ветеринарного врача и владельца животного. Владельцу нужно подробно рассказать о течении заболевания, его симптомах, методах лечения и побочных действиях препаратов. Обострения симптомов дерматита, вызванные вторичными инфекциями кожи, следует контролировать при помощи местного лечения, принимая во внимание восстановление эпидермального барьера. Врачу стоит помнить, что, чем шире спектр действия препарата, тем больше у него побочных эффектов. Комбинации глюкокортикостероидов, циклоспорина и оклацитиниба следует использовать с осторожностью из-за риска усиления иммуносупрессии. Аллерген-специфическая иммунотерапия — единственный модифицирующий течение заболевания метод лечения при атопическом дерматите собак, и ее подбирают для каждого пациента индивидуально.
-
1.Swinnen C, Vroom M. The clinical effect of environmental control of house dust mites in 60 house dust mite-sensitive dogs. Vet Dermatol 2004;15(1):31-36.
-
2.Picco F, Zini E, Nett C, et al. A prospective study on canine atopic dermatitis and food-induced allergic dermatitis in Switzerland. Vet Dermatol 2008;19(3):150-155.
-
3.Panzuti P, Vidémont E, Fantini O, et al. A moisturizer formulated with glycerol and propylene glycol accelerates the recovery of skin barrier function after experimental disruption in dogs. Vet Dermatol 2020;31:344-e89
-
4.Ollivier E, Zemirline C, Marchand L, et al. Effect of the ingredient A97614A1 on the adhesion and biofilm formation of Staphylococcus pseudintermedius in a model of reconstructed canine epidermis. In; Proceedings, 62nd BSAVA Congress, Birmingham, 2019.
-
5.Saevik BK, Bergvall K, Holm BR, et al. A randomized, controlled study to evaluate the steroid sparing effect of essential fatty acid supplementation in the treatment of canine atopic dermatitis. Vet Dermatol 2004;15:137-145.
-
6.Popa I, Remoue N, Osta B, et al. The lipid alterations in the stratum corneum of dogs with atopic dermatitis are alleviated by topical application of a sphingolipid-containing emulsion. Clin Exp Dermatol 2012;37(6):665-671.
-
7.Bradley CW, Morris DO, Rankin SC, et al. Longitudinal evaluation of the skin microbiome and association with microenvironment and treatment in canine atopic dermatitis. J Invest Dermatol 2016;136(6):1087-1089.
-
8.Morris DO, DeBoer DJ. Evaluation of serum obtained from atopic dogs with dermatitis attributable to Malassezia pachydermatis for passive transfer of immediate hypersensitivity to that organism. Am J Vet Res 2003;64(3):262-266.
-
9.Maynard L, Rème CA, Viaud S. Comparison of two shampoos for the treatment of canine Malassezia dermatitis: a randomised controlled trial. J Small Anim Pract 2011;52(11):566-572.
-
10.Kano R, Yokoi S, Kariya N, et al. Multi-azole-resistant strain of Malassezia pachydermatis isolated from a canine Malassezia dermatitis. Med Mycol 2019;57(3):346-350.
-
11.Olivry T, DeBoer DJ, Favrot C, et al. Treatment of canine atopic dermatitis: 2010 clinical practice guidelines from the International Task Force on Canine Atopic Dermatitis. Vet Dermatol 2010;21:233-248.
-
12.Olivry T, DeBoer DJ, Favrot C, et al. Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). BMC Vet Res 2015;11:210.
-
13.Nuttall T, Mueller R, Bensignor E, et al. Efficacy of a 0.0584% hydrocortisone aceponate spray in the management of canine atopic dermatitis: a randomised, double blind, placebo-controlled trial. Vet Dermatol 2009;20:191-198.
-
14.Lourenço AM, Schmidt V, São Braz B, et al. Efficacy of proactive long-term maintenance therapy of canine atopic dermatitis with 0.0584% hydrocortisone aceponate spray: a double-blind placebo-controlled pilot study. Vet Dermatol 2016;27:88-92.
-
15.Cosgrove SB, Cleaver DM, King VL. Long-term compassionate use of oclacitinib in dogs with atopic and allergic skin disease: safety, efficacy and quality of life. Vet Dermatol 2015;26:171-e35.
-
16.Banovic F, Gordon H, Tarigo J, et al. Modulatory effects of oclacitinib on in vitro canine T-cell proliferation and cytokine production. Vet Dermatol 2019;30(1):17-e6.
-
17.Panteri A, Strehlau G, Helbig R, et al. Repeated oral dose tolerance in dogs treated concomitantly with ciclosporin and oclacitinib for three weeks. Vet Dermatol 2016; 27:22-e7.
-
18.Dip R, Carmichael J, Letellier I, et al. Concurrent short-term use of prednisolone with cyclosporine A accelerates pruritus reduction and improvement in clinical scoring in dogs with atopic dermatitis. BMC Vet Res 2013;9:173.
-
19.Bensignor E, Olivry T. Treatment of localized lesions of canine atopic dermatitis with tacrolimus ointment: a blinded randomized controlled trial. Vet Dermatol 2005;16:52-60.
-
20.Moyaert H, Van Brussel L, Borowski S, et al. A blinded, randomized clinical trial evaluating the efficacy and safety of lokivetmab compared to ciclosporin in client-owned dogs with atopic dermatitis. Vet Dermatol 2017;28(6):593-e145.
-
21.Keppel K, Campbell K, Zuckermann F, et al. Quantitation of canine regulatory T cell populations, serum interleukin-10 and allergen-specific IgE concentrations in healthy control dogs and canine atopic dermatitis patients receiving allergen-specific immunotherapy. Vet Immunol Immunopathol 2008;123:337-344.
-
22.Loewenstein C, Mueller RS. A review of allergen-specific immunotherapy in human and veterinary medicine. Vet Dermatol 2009;20(2):84-98.
-
23.Hobi S, Mueller RS. Efficacy and safety of rush immunotherapy with alum-precipitated allergens in canine atopic dermatitis. Tierarztl Prax Ausg K Kleintiere Heimtiere 2014;42(3):167-173.
-
24.DeBoer DJ, Verbrugge M, Morris M. Clinical and immunological responses of dust mite sensitive, atopic dogs to treatment with sublingual immunotherapy (SLIT). Vet Dermatol 2016;27(2):82-7e23.
-
25.Timm K, Mueller RS, Nett-Mettler CS. Long-term effects of intralymphatic immunotherapy (ILIT) on canine atopic dermatitis. Vet Dermatol 2018;29(2):123-e49





 7528
7528  10 мин
10 мин



.png)




.jpg)


