Введение
Лимфомой (ранее ее часто называли лимфосаркомой; lymphosarcoma — LSA) называют гетерогенную группу новообразований, происходящих из лимфоцитов. Новообразования обычно развиваются в лимфоидных тканях, таких как лимфатические узлы, костный мозг и селезенка, но из‑за широкого распространения и миграции лимфоцитов могут появиться практически в любой ткани. Лимфома — одно из наиболее частых новообразований у кошек, ее включают в список дифференциальных диагнозов при выявлении практически любых объемных образований.
Со временем знания об эпидемиологии и клинических проявлениях лимфомы кошек значительно изменились, поскольку в конце 1970-х и 1980-х годах появились возможности для тестирования и элиминации вируса лейкемии кошек (FeLV), а в конце 1980-х — вакцины от FeLV. Уменьшение частоты случаев FeLV-ассоциированной лимфомы отражает снижение общей заболеваемости FeLV-инфекцией. Любопытно, что несмотря на это общая распространенность лимфомы кошек растет; по-видимому, в основном вследствие увеличения числа случаев лимфомы желудочно-кишечного тракта, а также других анатомических областей (1).
Истинная распространенность лимфомы кошек неизвестна. Типичной группы риска лимфомы кошек не существует, поскольку ее распространенность значительно изменяется в зависимости от анатомической локализации и статуса инфекции FeLV. Предполагается, что риск лимфомы повышен у сиамских кошек, причем у них могут развиваться биологически уникальные подтипы заболевания (2). Этиология лимфомы кошек
Вирусные факторы
Исторически основной причиной развития лимфомы кошек считали FeLV, и большинство случаев были связаны с активной инфекцией. Часто заболевание развивалось у молодых кошек, средний возраст которых составлял около трех лет. Кроме того, были выделены определенные анатомические подтипы, в значительной степени связанные с инфекцией FeLV, включая медиастинальную форму. Однако в наши дни в связи с низкой распространенностью FeLV эпидемиология лимфомы значительно изменилась: она развивается у кошек значительно более старшего возраста и поражает преимущественно определенные анатомические области, например желудочно-кишечный тракт.
FeLV непосредственно участвует в лимфомагенезе, поскольку встраивается в геном кошки, вызывая пролиферацию клеток и изменяя экспрессию генов (1). Инфекция вирусом иммунодефицита кошек (FIV) может повышать риск развития лимфомы, хотя, по имеющимся данным, он играет косвенную роль, вызывая иммуносупрессию. Лимфома, ассоциированная с FIV, чаще всего развивается из В-клеток, в отличие от связанной с FeLV, при которой преобладают Т-клетки (3).
Генетические и молекулярные факторы
Предрасположенность ориентальных пород кошек к развитию лимфомы предполагает потенциальный наследственный генетический фактор (2).
Факторы среды
Имеются некоторые данные о повышении риска развития лимфомы у кошек, подвергающихся воздействию табачного дыма из окружающей среды (4).
Иммуносупрессия
Помимо повышенного риска развития лимфомы у кошек с инфекцией иммуносупрессивным вирусом FIV также выявлено повышение риска развития рака, включая лимфому, у домашних кошек при терапии циклоспорином после трансплантации почки (5).
Хроническое воспаление
Предполагают связь лимфомы кишечника у кошек с воспалительными заболеваниями кишечника, а также потенциальную связь лимфомы желудка из лимфоидной ткани, ассоциированной со слизистой (mucosa-associated lymphoid tissue — MALT), с инфекцией Helicobacter, поскольку этот синдром хорошо изучен у человека. В исследовании на кошках в образцах биоптатов крупноклеточной лимфомы было выявлено статистически значимое увеличение частоты проникновения бактерий в слизистую и в сосуды (6). Предполагается, что хроническое воспаление в области инъекций у кошек может повышать риск развития подкожной лимфомы (7).
Лимфома средостения — клинические признаки
Медиастинальная форма может поражать тимус и регионарные (медиастинальные, трахеобронхиальные и стернальные) лимфатические узлы. У большинства кошек развиваются симптомы поражения органов грудной клетки, обусловленные либо пространственно-захватывающим эффектом опухоли, либо вторичным плевральным выпотом, который встречается очень часто. Клинически лимфома средостения проявляется одышкой (80%), тахипноэ, трудностями сжать грудную клетку в краниальном отделе, приглушенностью звука при аускультации сердца и легких. Сдавливание сосудов, дренирующих голову, может проявляться синдромами Горнера и верхней полой вены, с сопутствующим отеком головы и шеи. Однако, по опыту автора, синдром верхней полой вены при лимфоме средостения у кошек встречается значительно реже, чем при лимфоме средостения/тимоме у собак. Гиперкальциемия часто возникает при лимфоме средостения у собак, но очень редко встречается у кошек.
Большинство пациентов поступают с той или иной степенью одышки, и первоначальное ведение сводится к стабилизации состояния и оказанию неотложной помощи, пока они не почувствуют себя достаточно комфортно для проведения диагностики. Может потребоваться дать кислород, стараясь вызывать как можно меньше стресса у животного, а также провести седацию или анальгезию (например, буторфанолом) по показаниям. Необходимо быстро оценить наличие плеврального выпота (ультразвуковое исследование, рентгенография); если объем жидкости большой, ее необходимо быстро откачать, так как она в значительной степени усугубляет одышку.
В большинстве случаев поражение ограничивается средостением, хотя, безусловно, возможно вовлечение других групп регионарных или отдаленных лимфоузлов. Автор часто наблюдал вовлечение предлопаточных или даже поднижнечелюстных лимфатических узлов, особенно на поздних стадиях заболевания, нередко на фоне рецидива. Автор также наблюдал несколько случаев развития заболевания сразу с крупного объемного образования в предлопаточной области. При компьютерной томографии (КТ) оно оказалось не предлопаточным лимфоузлом, а распространением крупного образования из средостения.
Ранее большинство случаев лимфомы средостения описывали у молодых (средним возрастом 2–4 года), FeLV-положительных кошек с Т-клеточным иммунофенотипом опухоли. Однако, как и ожидалось, по мере снижения заболеваемости FeLV типичный фенотип лимфомы изменился. В недавнем британском исследовании с участием 55 кошек с лимфомой средостения большинство (>90%) имели отрицательный статус по FeLV/FIV антигенам, были молодыми (средний возраст — 3 года), самцами (соотношение коты : кошки = 3,2 : 1), и почти треть из них были сиамской породы (8). Иммунофенотип не описан, возможно потому, что у кошек его определяют редко. Вероятно, причиной этому служат данные большинства исследований, согласно которым у кошек, в отличие от собак, прогностическое значение определения иммунофенотипа ниже.
Лимфома средостения также встречается преимущественно у молодых, FeLV-отрицательных сиамских кошек, биологически менее агрессивна и реагирует на химиотерапию лучше, чем FeLV-ассоциированные формы.
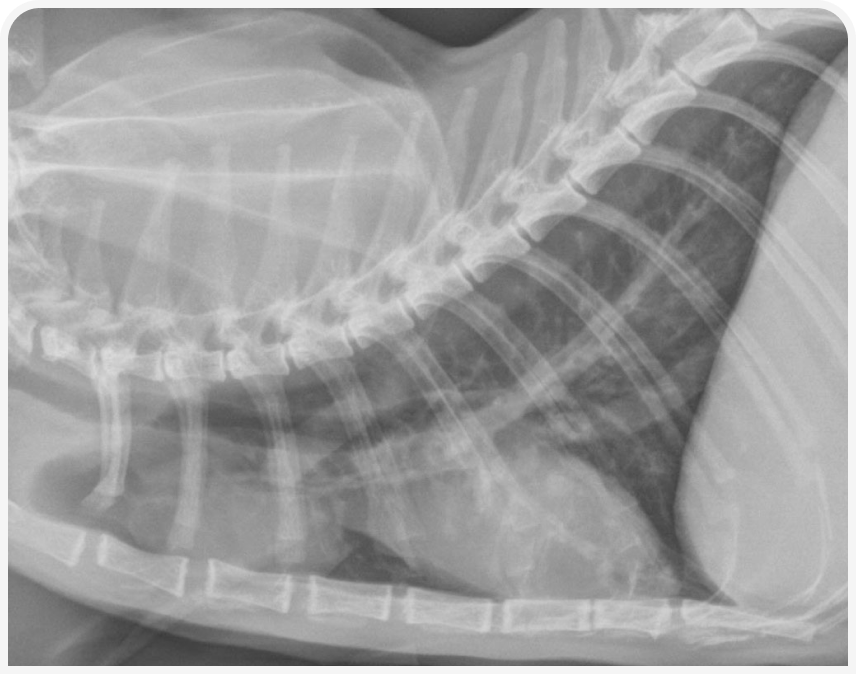
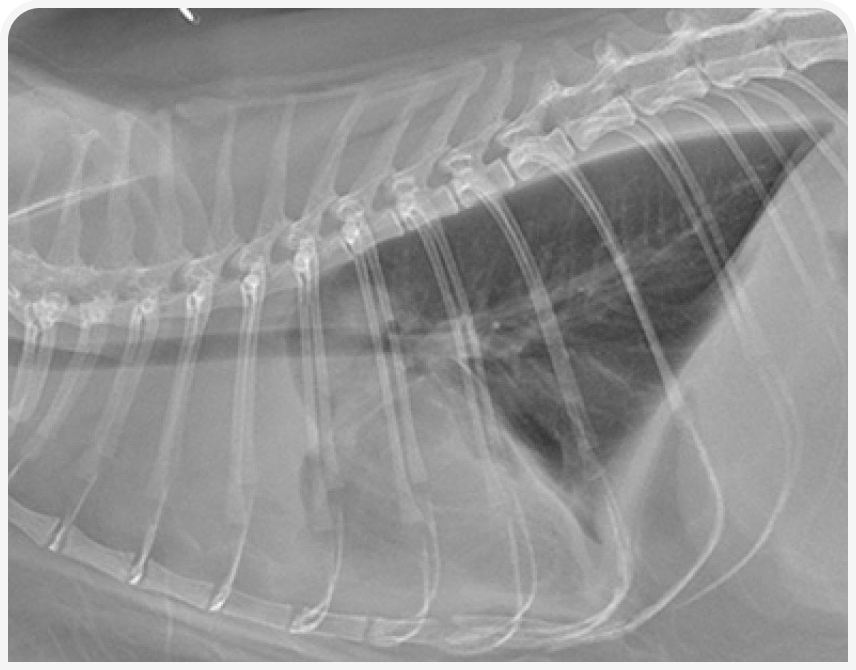
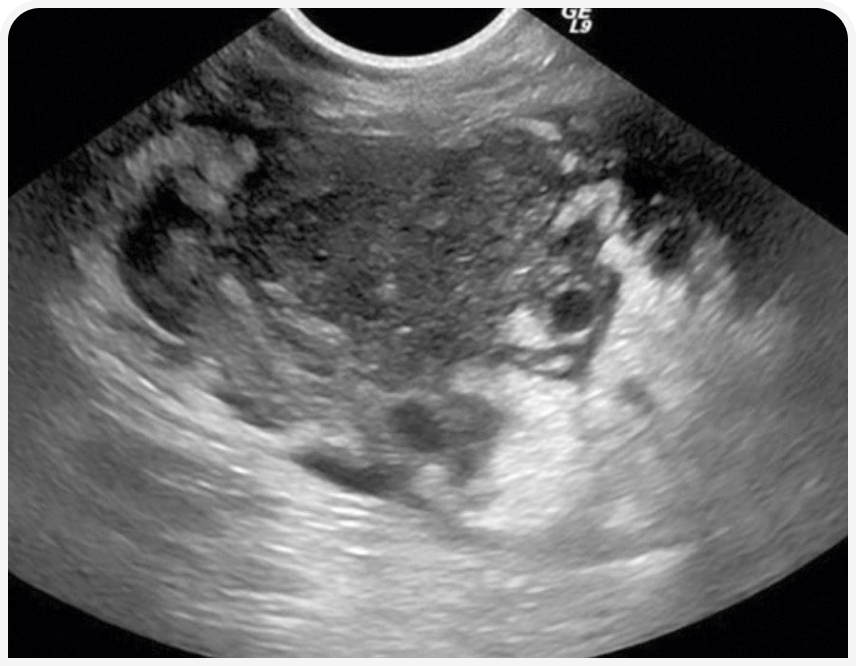
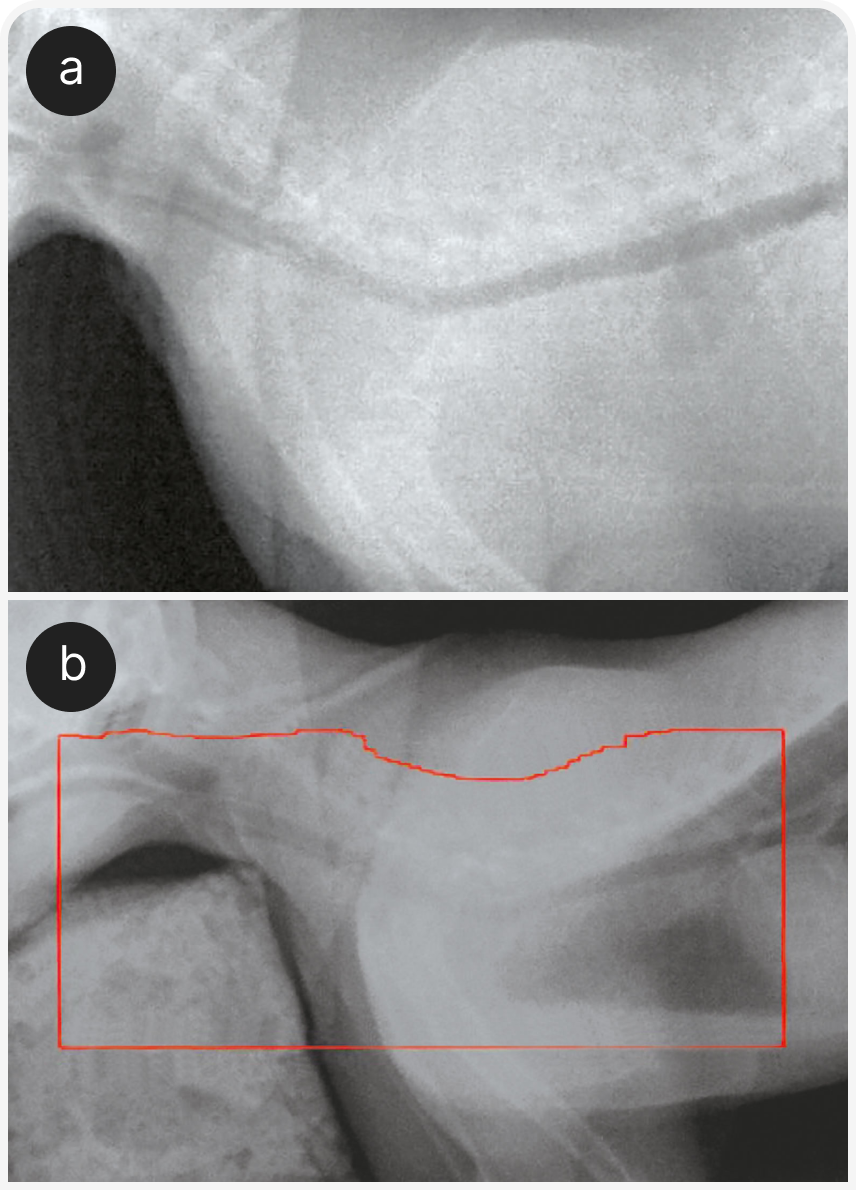
При рентгенографии органов грудной клетки можно выявить четко визуализируемое объемное образование в средостении (Рисунок 1), хотя иногда значительный плевральный выпот может затруднить визуализацию или сделать ее невозможной до тех пор, пока его не дренируют (Рисунок 2), поэтому могут потребоваться повторная рентгенография или УЗИ (Рисунок 3).
КТ может быть полезна, поскольку позволяет визуализировать образование независимо от наличия выпота; однако этот метод визуализации обычно не облегчает окончательную диагностику, поскольку дифференциальных диагнозов объемных образований в средостении у кошки несколько.
Для установления диагноза может быть достаточно цитологического исследования тонкоигольного аспирата (FNA) образования или плевральной жидкости. У большинства кошек лимфома легко отделяется при тонкоигольной аспирации; диагноз подтверждают при обнаружении мономорфной популяции промежуточных или крупных лимфоидных клеток (Рисунок 4). В некоторых случаях окончательная диагностика лимфомы у кошек с объемным образованием в средостении может оказаться более сложной.
Основной дифференциальный диагноз для лимфомы средостения — тимома. Цитологически тимому во многих случаях можно отличить от лимфомы, но диагностику может осложнять преобладание в тимоме малых лимфоцитов. Тучные клетки также визуализируют в 50% аспиратов из тимомы (Рисунок 5). В неоднозначных случаях может оказаться полезным дополнительно оценить иммунофенотипические показатели и клональность.
При неоднозначном диагнозе можно провести следующие дополнительные диагностические исследования.
• Проточная цитометрия: при этом образец FNA образования или плевральной жидкости, содержащий раковые клетки (перенесенные в специальную среду, предоставленную лабораторией), анализируют на проточном цитометре. По размеру, сложности и маркировке специфическими маркерами поверхности клеток можно диагностировать лимфому и определить ее фенотип (В или Т). Хотя этот метод оказался эффективен у собак, у кошек его используют реже, и некоторые лаборатории в настоящее время не рекомендуют применять это исследование у кошек.
• PARR-анализ (ПЦР на антигенно-рецепторные перестройки): в этом случае на цитологических предметных стеклах или в биоптатах (даже если они уже окрашены и высушены или зафиксированы в формалине) из клеток выделяют и анализируют ДНК. Большинство лимфом возникают из В- или Т-лимфоцитов, и все клетки будут клонами одной клетки-предшественника. Таким образом, при этом исследовании пытаются установить, имеют ли все анализируемые клетки генетически идентичные рецепторы В- или Т-клеток (и поэтому раковые) или же они генетически разнообразны (т. е. не являются раковыми, например воспалительная популяция лимфоцитов).
Наконец, при крупных образованиях, сообщающихся с грудной стенкой, может быть полезна биопсия Tru-Cut (для обеспечения низкого риска возникновения ятрогенного пневмоторакса), но, по опыту автора, в настоящее время этот метод диагностики требуется редко.
Химиотерапия, безусловно, используется для лечения лимфомы средостения у кошек наиболее широко. Как правило, лимфому считают системным заболеванием, даже если на момент диагностики она локализованная. Это означает, что при локализованной лимфоме (например, лимфоме средостения) даже отсутствие поражений других анатомических локализаций по данным визуализации (или даже цитологии, например, печени или селезенки) не позволяет исключить наличие раковых клеток на микроскопическом уровне. Поэтому целью цитотоксической химиотерапии является лечение как выявленного макроскопического поражения, так и любых скрытых микроскопических очагов заболевания.
Хирургическое вмешательство при лимфоме средостения у кошек по изложенным выше причинам, а также в связи с высокой частотой развития осложнений и риском при торакальных хирургических вмешательствах не показано. Необходимость дождаться заживления также отсрочит начало химиотерапии. Кроме того, лекарственная терапия обычно (по крайней мере, на начальном этапе) высоко эффективна, и лимфома реагирует очень быстро. Поэтому, хотя после хирургического удаления некоторых типов опухолей у животных клиническое состояние быстро улучшается, к лимфоме средостения это не относится.
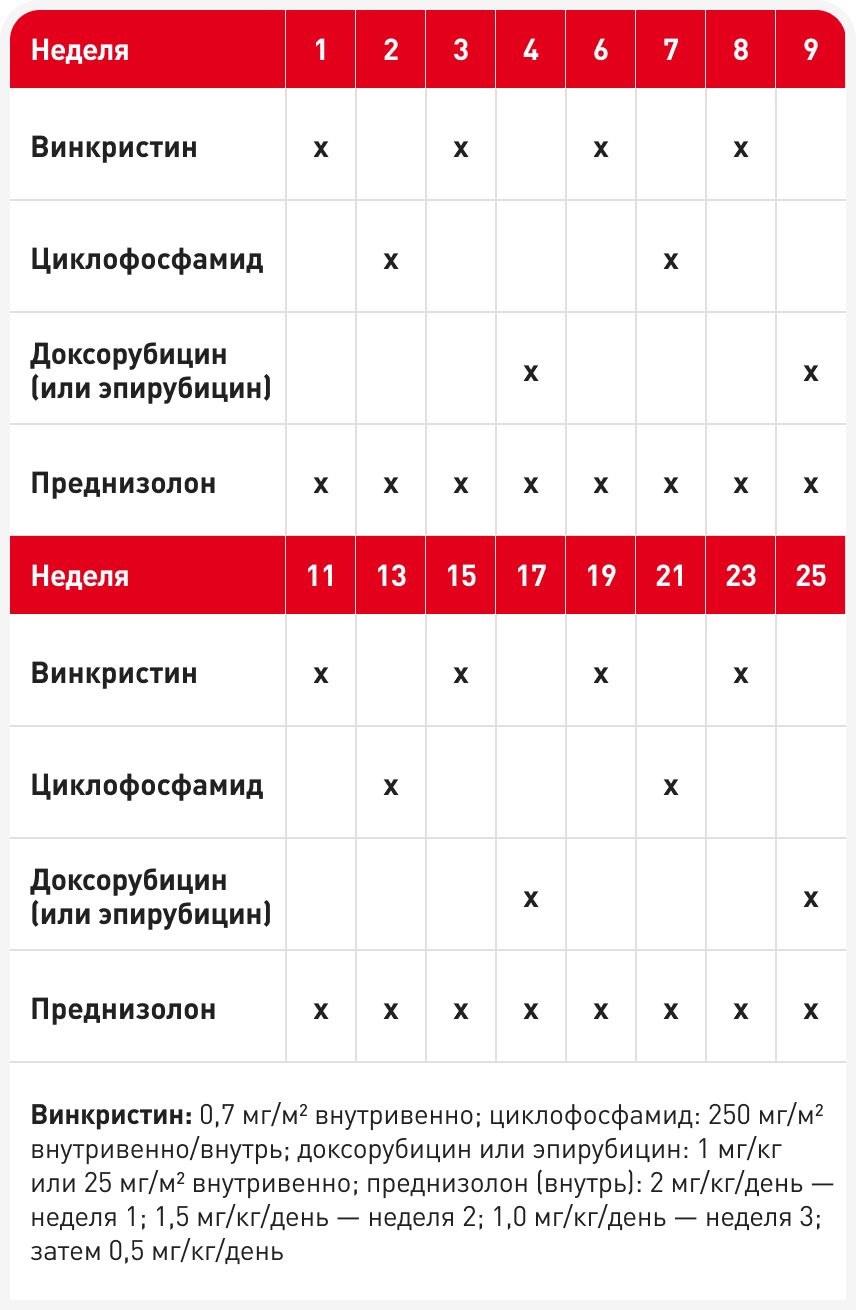
У большинства кошек при лимфоме любой локализации, включая средостение, показаны протоколы COP (циклофосфамид, винкристин (онковин) и преднизолон/преднизон) или CHOP (COP плюс доксорубицин (гидроксидаунорубицин)), как показано в Таблицах 1 и 2. Протоколы типа CHOP являются стандартом лечения людей с наиболее распространенными типами лимфомы. Точно так же лимфома собак (особенно В-клеточного типа) большинством онкологов обычно лечится первой линией с помощью протокола CHOP (то есть с включением доксорубицина). Выбор лучшего варианта лечения лимфомы кошек любой локализации менее однозначен; широко используют протоколы COP и CHOP, и в большинстве исследований значительного преимущества CHOP перед COP не выявлено. Кроме того, у кошек доксорубицин в качестве монотерапии по сравнению с собаками, по-видимому, менее эффективен и часто вызывает нефротоксическое действие. Учитывая предрасположенность стареющих кошек к хроническим заболеваниям почек, эти ограничения необходимо учитывать при составлении плана лечения.
Доксорубицин также активно вызывает на коже образование пузырей (везикант), что в случае экстравазации приводит к обширному слущиванию тканей, поэтому кошкам для безопасного введения препарата, в зависимости от темперамента, может потребоваться седация. Тем не менее кардиотоксичность доксорубицина у кошек при стандартных дозах и графике применения очень маловероятна.
В ретроспективном исследовании у кошек с лимфомой средостения, получавших лечение по протоколам COP или CHOP, общая частота достижения ответа составила 95%, а общая медиана времени выживания (median survival time — MST) составила чуть больше года (а в случае достижения полного ответа — 980 дней) (8). Частота достижения полного (CR) и частичного (PR) ответа между протоколами COP и CHOP значимо не различалась, а общая медиана выживаемости составила 373 дня (диапазон 20–2015 дней). Выживаемость кошек, достигших CR, увеличивалась (медиана 980 дней по сравнению с 42 днями для группы PR). Возраст, порода, пол, локализация (средостение или средостение плюс другие области тела), вирусный статус и предварительное лечение стероидами на ответ или выживаемость не влияли. FeLV-позитивных кошек в этом исследовании было мало (9%), при этом в большем количестве оказались представлены самцы и молодые сиамские кошки.
Напротив, прогноз лимфомы средостения у молодых FeLV-положительных кошек обычно неблагоприятный, и после лечения по протоколам CHOP или COP можно ожидать MST от 2 до 3 месяцев. Немного более благоприятные результаты получены в недавнем небольшом ретроспективном исследовании в Бразилии, где у кошек с лимфомой средостения (из 90% FeLV-позитивной популяции) при использовании нового протокола, включавшего винкристин, преднизолон, доксорубицин и ломустин, MST составила около 7 месяцев (9).
Химиотерапию не следует проводить строго «по формуле», и, хотя протоколы полезны в качестве отправной точки, для каждого пациента их нужно подбирать индивидуально. Нежелательные эффекты могут включать желудочно-кишечные расстройства, миелосупрессию (в основном нейтропению) и — редко — специфическую токсичность препарата, например вызванное доксорубицином поражение почек. Для подбора оптимальной интенсивности дозы — т. е. для принятия решения об увеличении, уменьшении или сохранении дозы химиотерапии — необходимо знать анамнез пациента, предыдущий ответ на химиотерапию, побочные эффекты, а также соответствующие данные анализов крови. Большинство врачей приступают к химиотерапии при условии, что абсолютное количество нейтрофилов (не общее количество лейкоцитов!) превышает 2,5х109/л, но в зависимости от ряда факторов можно проводить химиотерапию и при меньшем количестве. На самом деле определенного количества нейтрофилов, позволяющего продолжать данный протокол, не существует, и у разных практикующих врачей опыт разный, а некоторые клиницисты устанавливают разные границы для разных препаратов. Например, доксорубицин обладает выраженным миелосупрессивным действием и может вызвать тяжелую нейтропению, поэтому при его использовании некоторые онкологи устанавливают более высокий порог количества нейтрофилов, при котором приступают к введению следующей дозы. Кроме того, некоторые врачи могут более осторожно подходить к подбору дозы у ослабленных пациентов, при тяжелой нейтропении в анамнезе или при серьезных опасениях владельца животного относительно возможных побочных эффектов. И наоборот, если нейтропения/миелосупрессия полностью отсутствуют и клинических побочных эффектов нет, некоторые клиницисты могут увеличивать дозы при последующих курсах лечения выбранным препаратом. В недавно проведенном исследовании было показано, что у собак, получавших лечение лимфомы по 19-недельному протоколу CHOP, лечение продолжали, пока количество нейтрофилов было >1,5×109/л; это сократило количество задержек введения препарата и не привело к значительному увеличению частоты развития нежелательных эффектов. Хотя такие данные для кошек в настоящее время не опубликованы, вполне вероятно, что «безопасный» порог для химиотерапии может быть ниже 2,5х109/л, но при значительной нейтропении может потребоваться снижение дозы препарата или увеличение интервалов между введением препарата.
Таким образом, если количество нейтрофилов у кошки ниже выбранного предела для назначения дозы, следует отложить введение препарата на 2–7 дней (в зависимости от величины нейтропении). Если нейтропения при последующих введениях сохраняется или протекает тяжело, при последующих введениях может потребоваться снизить дозу.
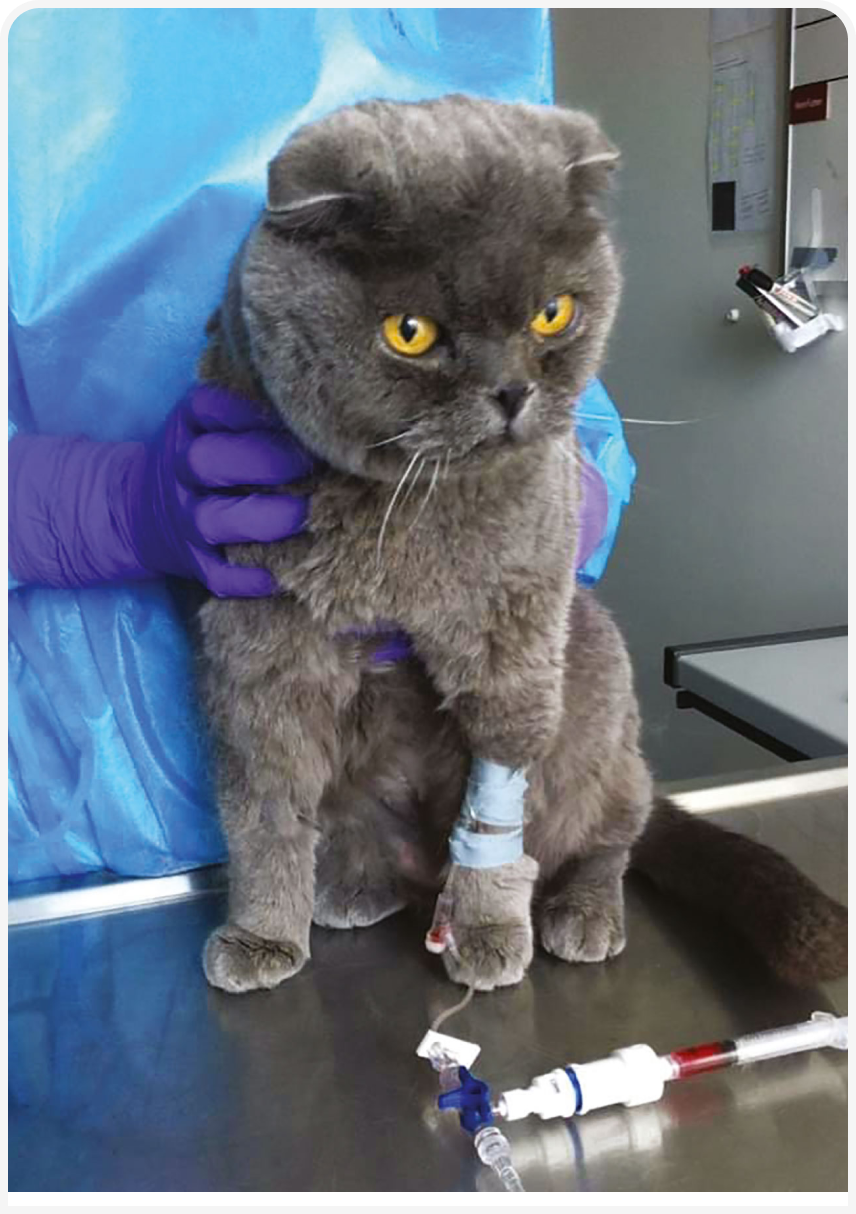
В такой коррекции и заключается искусство химиотерапии, которое приходит отчасти с опытом, а отчасти по мере лечения конкретного пациента; большинство кошек переносят химиотерапию хорошо. Таким образом, при наличии соответствующего опыта и навыков, изменения препарата или дозы, снижения дозы или перерывов, изменения частоты приема препарата и противорвотной профилактики, можно обеспечить кошке во время прохождения химиотерапии отличное качество жизни. Следует отметить, что кошки устойчивы к циститу, вызванному циклофосфамидом, и кардиотоксичности, вызванной доксорубицином, и у них редко развивается сепсис даже при тяжелой лекарственной нейтропении. По данным множества исследований, при химиотерапии по поводу лимфомы большинство владельцев остаются довольны качеством жизни животных (10) (Рисунок 6).
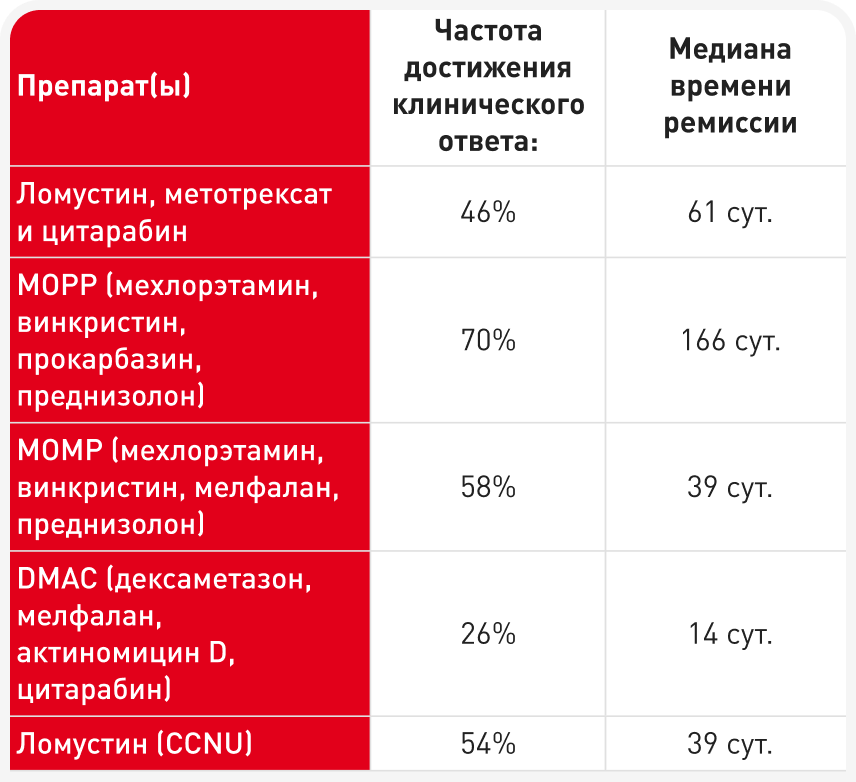
При повторном развитии клинических проявлений можно перейти на ряд протоколов неотложной химиотерапии с использованием различных препаратов, воздействию которых опухолевые клетки еще не подвергались (Таблица 3). К сожалению, ко многим из этих препаратов часто имеется врожденная или приобретенная перекрестная резистентность. Рецидив у кошек часто протекает тяжело, и времени для опробования различных протоколов неотложной терапии, чтобы определить наиболее эффективный режим, может оказаться меньше. Частота достижения ответа обычно скромная, и ответ, как правило, недолгий, хотя при достижении сильного частичного или полного ответа исход значительно улучшается.
Лучевая терапия обычно высоко эффективна при некоторых типах солитарной лимфомы у кошек, особенно при лимфоме носа, но интересно, что при лимфоме средостения ее используют редко. Причины этого, вероятно, многофакторные, включая предыдущую ассоциацию с FeLV и неблагоприятный прогноз, недостаточную доступность лечебных центров, потенциально менее благоприятный прогноз (повторной) анестезии, трудности в наведении на опухоль из‑за дыхательных движений, больших объемов плеврального выпота, большого размера опухолей и предполагаемой радиочувствительности нормальных внутригрудных тканей вблизи опухоли (особенно перикарда, сердца и легких). Лимфоциты высокочувствительны к радиации и погибают очень быстро, поэтому лимфомы часто лечат более низкими дозами облучения, чем большинство других типов опухолей. С появлением более совершенных облучающих установок этот метод терапии может приобрести еще большее терапевтическое значение. Например, медиастинальная лимфома часто рецидивирует в средостение, поэтому лучевая терапия изолированно или в сочетании с химиотерапией может уничтожать опухолевые лимфоциты эффективнее одной только химиотерапии и может быть включена в схему первой линии лечения, проводимого с целью окончательного излечения. На сегодняшний день автор в основном проводил лучевую терапию в качестве паллиативного лечения при рецидивах после первоначального лечения системной химиотерапией и достигал благоприятных (хотя и временных) результатов (Рисунок 7).
Лимфома средостения у кошек в основном дебютирует относительно остро, с респираторных симптомов, и часто требует неотложного триажа и лечения, хотя диагноз установить относительно легко. В наши дни лимфома средостения обычно наблюдается у кошек с отрицательным статусом FeLV, а прогноз выживания при подходящей химиотерапии превышает год. У кошек, достигших полной ремиссии, ее продолжительность может быть очень длительной (>2,5 лет). Особенно благоприятен прогноз у молодых самцов ориентальных пород с отрицательным FeLV-статусом, но большинство кошек положительно реагируют на химиотерапию и могут иметь хорошее качество жизни в процессе лечения. Лимфома средостения — диагностика
.png)
.png)

Варианты лечения и прогноз

Заключение


телефона ниже для сброса пароля.



на номер
+7 {{ formatted_phone }}


Вы успешно прошли тест!
{{ formatted_phone }}.
Введите последние четыре цифры номера входящего звонка.

весь модуль
всех видеоуроков модуля














 3669
3669  10 мин
10 мин







