Введение
Медь является необходимым микроэлементом, который играет жизненно важную роль в самых разных биологических процессах. Однако в избыточных количествах медь чрезвычайно токсична, поскольку свободные ионы меди вызывают образование активных форм кислорода, повреждающих белки, липиды и ДНК. Для предотвращения этого токсического воздействия гомеостаз меди в организме жестко регулируется с помощью различных медьсвязывающих белков (1). Медь, содержащаяся в пище или питьевой воде, всасывается в желудочно-кишечном тракте (ЖКТ). На базолатеральной стороне энтероцитов располагается транспортер меди АТР7А, осуществляющий перемещение атомов меди через базолатеральную мембрану в воротную систему сосудов (Рисунок 1). Через воротную систему медь попадает в печень, которая играет центральную роль в метаболизме, накоплении и выведении этого элемента. Внутри гепатоцитов медь захватывается специализированными клеточными органеллами и включается в состав белков, где выполняет различные функции. Гепатоциты также выполняют функцию накопления меди и регулируют перераспределение меди в другие органы.Избыток меди транспортируется через мембрану комплекса Гольджи гепатоцитов и выводится с желчью. В этом процессе экскреции важную роль играет транспортер меди ATP7B, который структурно связанс ATP7A (Рисунок 1). Предполагают, что белок COMMD1 необходим для правильного функционирования ATP7B в процессе выведения избытка меди с желчью.
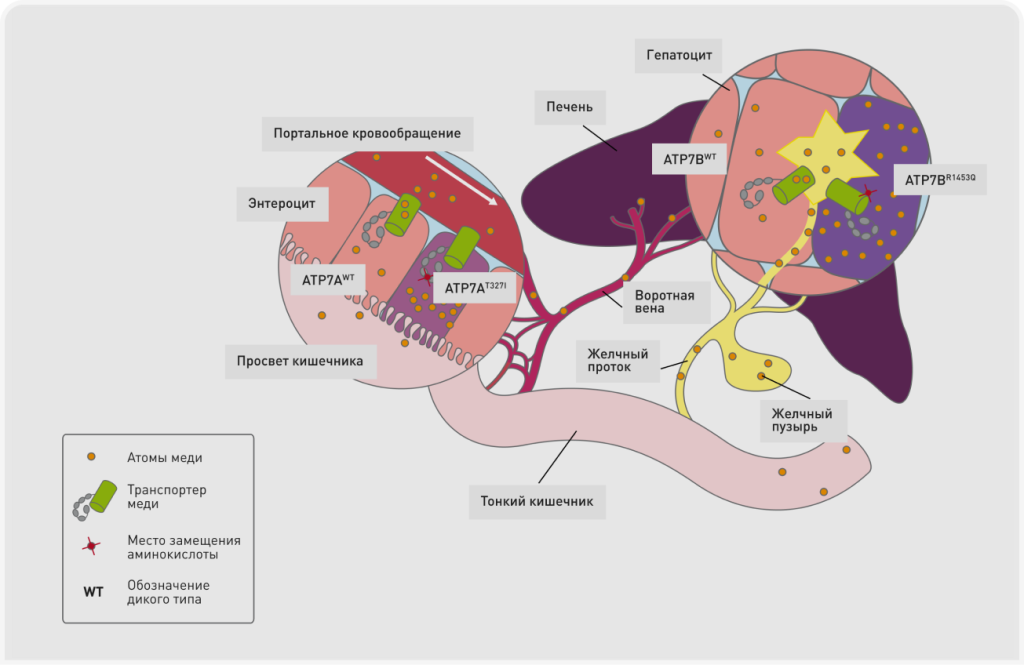
Важность транспортеров ATP7A и ATP7B в гомеостазе меди подтверждается разрушительными проявлениями наследственных дефектов в каждом из этих белков у пациентов. У детенышейс мутациями в ATP7A развивается болезнь Менкса – смертельное заболевание, которое характеризуется тяжелым дефицитом меди и неврологическими нарушениями (2). Мутации в гене ATP7B вызываюту людей болезнь Вильсона, при которой избыточное накопление меди в тканях печени и нейронах приводит к печеночной недостаточности и/или неврологическим либо психическим расстройствам (3).
Этиология

Медь-ассоциированный гепатит, вызванный избыточным накоплением меди в тканях печени у собак, похож на болезнь Вильсона у людей, за исключением того факта, что у собак не формируется узнаваемый неврологический фенотип. Яркий пример наследственного медь-ассоциированного гепатита встречается у бедлингтон-терьеров (Рисунок 2). У этой породы делеция второго экзона гена COMMD1 приводит к полному отсутствию белка COMMD1 в печени, вследствие чего выведение меди с желчью снижается (Рисунок 1) (4). У этой породы предельные значения содержания меди в печени могут составлять до 10 000 мг/кг сухой массы печени, а накопленная в тканях печени медь неизбежно приводит к циррозу печени. К счастью, с развитием ДНК-тестирования это заболевание в популяции бедлингтон-терьеров удалось почти полностью искоренить.
У ряда других пород медь-ассоциированный гепатит выявляется все чаще. Исследования родословной, проведенные у лабрадор-ретриверов, доберманов, вест-хайленд-уайт-терьеров, скай-терьерови далматинов, подтверждают наследственную природу этой патологии. При исследовании лабрадор-ретриверов были обнаружены мутации в генах переносчиков меди ATP7A и ATP7B с соответствующим снижением или повышением содержания меди в печени (5); также обнаружилось, что самки сильнее предрасположены к этому заболеванию. Кроме того, между потреблением меди с кормом и содержанием меди в печени была обнаружена значимая корреляция, из чего следует, что потребление меди с кормом представляет собой фактор риска развития медь-ассоциированного гепатита. У других пород собак можно предположить аналогичную сложную этиологию развития медь-ассоциированного гепатита: мутация соответствующих генов создает предрасположенность к заболеванию, однако возможность развития клинических проявлений заболевания зависит от внешних факторов, в особенностиот потребления меди (6).
Клинические признаки
На ранних стадиях накопления меди в печени, до того, как начнется выраженное повреждение тканей печени, клинические признаки у собак обычно отсутствуют. Когда медь продолжает накапливаться, вызывая повреждение гепатоцитов, одним из первых отклонений от нормы, обнаруживаемым лабораторными методами, становится повышение уровня трансаминаз, особенно АЛТ, однако оно пока что может быть очень незначительным. Процесс обычно протекает в хронической форме, и циклы накопления меди, повреждения гепатоцитов, фагоцитоза поврежденных гепатоцитов, заполненных медью, макрофагами, инициирования воспаления и фиброзирования повторяются много раз. Клинические признаки проявляются лишь тогда, когда гепатит становится сильно выраженным или когда развивается цирроз печени. Возраст возникновения первых клинических проявлений может варьироваться от 2–11 лет, хотя у большинства собак они проявляются в среднем возрасте (6–7 лет).

«
Гистологическое исследование ткани печени – единственный способ диагностики медь-ассоциированного гепатита у других пород, кроме бедлингтон-терьеров
Сначала клинические признаки могут быть малозаметными и неспецифическими: снижение активности, снижение аппетита и рвота. По мере прогрессирования заболевания клиническая картина будет развиваться с появлением признаков, характерных для конечной стадии заболевания печени, включающих потерю веса, желтуху, асцит и гепатоэнцефалопатию. Клинические признаки могут сопровождаться повышением уровней ферментов печени, билирубина и желчных кислот, снижением уровней альбумина и коагуляционных факторов (особенно фибриногена), а также развитием портальной гипертензии и и формированием коллатерального кровообращения с повышением уровня аммиакав крови. По отклонениям от нормы, выявляемым клиническими и лабораторными методами, невозможно отличить заболевание печени, вызванное избыточным накоплением меди, от хронического гепатита, вызванного любой другой причиной. У бедлингтон-терьеров зафиксированы гемолитические кризы, возникающие вследствие массированного выброса меди из гепатоцитов в кровяное русло, однакоу других пород такое явление не встречалось. У некоторых пород собак, в том числе у лабрадор-ретриверов, описан синдром Фанкони, развивающийся вследствие одновременного накопления медив проксимальных почечных канальцах. Это состояние обратимо при использовании хелаторной терапии (7).
Диагностика
Гистологическое исследование ткани печени представляет собой единственный способ диагностики медь-ассоциированного гепатита у других пород собак, кроме бедлингтон-терьеров. У этой породы болезнь наследуется моногенно, и наличие двух копий мутации гена COMMD1 неизбежно приводитк развитию медь-ассоциированного гепатита, если этот элемент присутствует в пище или питьевой воде.
У лабрадор-ретриверов прогнозирование риска по анализу генов ATP7A и ATP7B может быть обоснованным, если у собаки присутствует пограничный генотип. Однако фактическое содержание меди в организме зависит от потребления меди в течение жизни собаки. Этот параметр часто бывает трудно оценить, и это усложняет достоверность прогнозирования риска для конкретной собаки исключительно по данным генотипирования. Биопсия печени исследуется с применением обычного окрашивания гематоксилин-эозином, для обнаружения ретикулина используется метод Гордона и Свита, рубеановодородная кислота или роданин – для обнаружения меди. Локализация отложений медив центролобулярной зоне печеночных долек характерна для первичной интоксикации медью. Гепатоциты, в которых откладывается медь, окружены воспалительным мононуклеарным или смешанным инфильтратом. На более поздних стадиях болезни можно наблюдать апоптоз и некроз пораженных гепатоцитов и заполнение макрофагов (клеток Купфера) медью, которое может обнаруживаться в сочетании с центрозональным гепатоцитарным накоплением меди (Рисунок 3).На еще более поздних стадиях заболевания наблюдаются апоптоз, некроз, регенерация и типичный центро-центральный мостовидный фиброз, которые на финальной стадии приводят к микроузелковому или крупноузелковому циррозу печени.
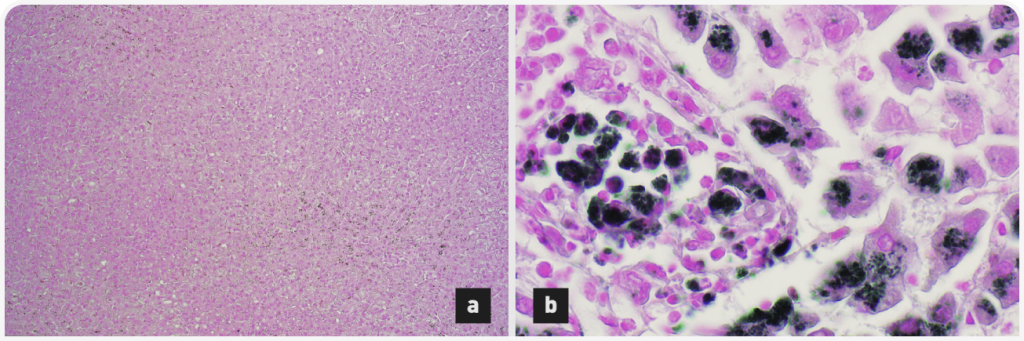
Для количественного определения содержания меди в печени применяется гистологическая система классификации от 0 (отсутствие накопления меди) до 5 баллов (диффузное панлобулярное присутствие гепатоцитов с многочисленными медьсодержащими гранулами, обычно с присутствием медьсодержащих макрофагов). Оценка 2 балла или выше расценивается как отклонение от нормы. Если медь обнаруживается при гистологическом исследовании, целесообразно исследовать содержание медив дополнительном образце ткани печени. Концентрацию меди в тканях печени можно количественно оценить путем облучения биоптатов и измерения индуцированной радиоактивности меди, либо спектрофотометрическими методами. Образцы биопсии печени сначала подвергаются вакуумной сушке, все значения рассчитываются на сухую массу образца (СМО). Концентрация меди в диапазоне 150–400 мг/кг СМО считается нормальной для собаки. У бедлингтон-терьеров может встречаться концентрация меди в печени выше 10000 мг/кг СМО, тогда как у других пород собак зарегистрирована концентрациядо 4000 мг/кг СМО.
Варианты лечения
Терапевтический подход к лечению медь-ассоциированного гепатита заключается в создании отрицательного баланса меди. Его можно достигнуть путем ограничения потребления меди или предотвращения всасывания меди путем добавления дополнительного количества цинка в рацион,а также путем стимулирования выделения меди с помощью хелаторов.
Диетотерапия
Ограничения потребления меди можно добиться назначением диеты с низкой концентрацией меди и прекращением использования медьсодержащих минеральных добавок. Сбалансированные диеты с низким содержанием меди для собак имеются в продаже, обычно они называются «диеты при заболеваниях печени». Например, в рационах ROYAL CANIN – это ветеринарная диета HEPATIC. Дополнительным преимуществом этих диет является то, что их можно давать собакам с признаками гепатоэнцефалопатии; они также обычно отличаются хорошими вкусовыми качествами, что может быть актуально для животных со сниженным аппетитом. Корректировка диеты может предотвратить дальнейшее накопление меди у собак на ранних стадиях заболевания (8), однако реакция на диетуу разных животных может быть различной, поэтому необходимо по-прежнему непрерывно контролировать концентрацию меди в печени. У бедлингтон-терьеров с экстремально высоким накоплением меди в печени одной только корректировкой диеты, без применения других методов, обойтись не получится. После успешной хелаторной терапии в долгосрочной перспективе полезно назначение диеты с низким содержанием меди и высоким содержанием цинка, поскольку такой рацион замедляет повторное накопление меди в печени (9). Цинк снижает всасывание меди в желудочно-кишечном тракте, так как он срабатывает катализатором металлотионеинов в энтероцитах, которые связывают медь. При обновлении энтероцитов медь, связанная в них, выводится с фекалиями. Некоторым собакам для предотвращения прогрессирования заболевания может оказаться достаточно одного курса D-пеницилламина и последующей корректировки рациона.
Хелаторная терапия
D-пеницилламин связывает медь с SH-группой и способствует выведению меди с мочой (10).Он образует относительно стабильные хелаты со всеми биологически активными металлическими микроэлементами, включая железо и цинк, а также способствует выведению этих металлов с мочой. Рекомендуемая доза составляет 10–15 мг/кг два раза в день.

Для усиления абсорбции препарат следует давать за 1–2 часа до кормления или после него (Таблица 1). D-пеницилламин всасывается в желудкеи верхних отделах кишечника. В качестве побочных эффектов у собак часто встречаются отсутствие аппетита и рвота, однако их можно избежать, постепенно увеличивая дозу. Кроме того, возникновение побочных эффектов может зависеть от того, какая форма препарата используется (составные капсулы или таблетки, покрытые кишечнорастворимой оболочкой). Лечение следует продолжать до тех пор, пока не будет достигнута нормализация содержания меди в печени. Для определения этого момента необходимо регулярно проводить биопсии печени для оценки концентрации меди (Рисунок 4). Бедлингтон-терьерам обычно требуется пожизненное непрерывное лечение D-пеницилламином, тогда как у других пород непрерывное лечение этим препаратом может привести к дефициту меди, а в некоторых случаях и цинка. Таким собакам рекомендуется курсовой режим лечения с ежегодным гистопатологическим исследованием биопсии печени. Необходимая продолжительность лечения рассчитывается исходя из концентрации меди в биопсии печени до начала лечения (11).
Цинк
Пероральный прием цинка блокирует всасывание меди в энтероцитах. Рекомендуемая доза составляет 5–10 мг пищевого цинка на кг массы животного два раза в сутки (Таблица 1), при этом сначала используются дозировки из верхней части диапазона, затем дозировка снижается, и полученная доза поддерживается длительное время (12). Рекомендуется давать препарат за 1–2 часа до или после кормления, так как пища может снизить эффективность препарата. Избыточное поступление цинкав организм может быть вредным; при уровне цинка в плазме выше 1000 мкг/дл может развиться гемолиз, поэтому для обеспечения безопасности во время лечения необходимо контролировать уровень цинка в плазме. Следует учитывать, что может потребоваться около трех месяцев, прежде чем перорально принимаемые препараты цинка обеспечат эффективное блокирование всасывания медив кишечнике, поэтому при лечении клинических случаев медь-ассоциированного гепатитане рекомендуется ограничиваться только применением препаратов цинка.
-
1.Kim BE, Nevitt T, Thiele DJ. Mechanisms for copper acquisition, distribution and regulation. Nat Chem Biol 2008;4:176-185.
-
2.Kaler SG. ATP7A-related copper transport diseases — emerging concepts and future trends. Nat Rev Neurol 2011;7:15-29.
-
3.Roberts EA, Schilsky ML. American Association for Study of Liver Diseases (AASLD). Diagnosis and treatment of Wilson Disease: an update. Hepatology 2008;47:2089-2111.
-
4.van de Sluis B, Rothuizen J, Pearson PL, et al. Identification of a new copper metabolism gene by positional cloning in a purebred dog population. Hum Mol Genet 2002;11:165-173.
-
5.Fieten H, Gill Y, Martin AJ, et al. The Menkes and Wilson Disease genes counteract in copper toxicosis in Labrador Retrievers: a new canine model for copper metabolism disorders. Dis Model Mech 2016;9:25-38.
-
6.Fieten H, Hooijer-Nouwens BD, Biourge VC, et al. Association of dietary copper and zinc levels with hepatic copper and zinc concentration in Labrador Retrievers. J Vet Intern Med 2012;26:1274-1280.
-
7.Langlois DK, Smedley RC, Schall WD, et al. Acquired proximal renal tubular dysfunction in 9 Labrador Retrievers with copper-associated hepatitis (2006-2012). J Vet Intern Med 2013;27:491-499.
-
8.Fieten H, Biourge VC, Watson AL, et al. Dietary management of Labrador Retrievers with subclinical hepatic copper accumulation. J Vet Intern Med 2015;29:822-827.
-
9.Fieten H, Biourge V, Watson A, et al. Nutritional management of inherited copper-associated hepatitis in the Labrador Retriever. Vet J 2014;199:429-433.
-
10.Fieten H, Hugen S, van den Ingh TS, et al. Urinary excretion of copper, zinc and iron with and without D-penicillamine administration in relation to hepatic copper concentration in dogs. Vet J 2013;2:468-473.
-
11.Fieten H, Dirksen K, van den Ingh TS, et al. D-penicillamine treatment of copper associated hepatitis in Labrador Retrievers. Vet J 2013;196:522-527.
-
12.Brewer GJ, Dick RD, Schall W, et al. Use of zinc acetate to treat copper toxicosis in dogs. J Am Vet Med Assoc 1992;201:564-568.




 1451
1451  15 мин
15 мин












