Введение
Растущий объем исследований подтверждает наличие у многих видов важной связи между кишечником и почками (так называемой оси кишечник — почки) (Рисунок 1). Обе системы значительно влияют друг на друга, что может иметь значительные клинические последствия. У кошек с хронической болезнью почек (ХБП) развивается дисбиоз, что подтверждает идею о том, что терапевтическое воздействие на кишечник может потенциально повышать продолжительность жизни и способствовать лечению сопутствующих заболеваний. В этой статье рассматривается современное понимание оси кишечник — почки и дается обзор доступных ветеринарным врачам стратегий оздоровления кишечного микробиома, что способствует снижению накопления опасных уремических токсинов, поступающих из кишечника.
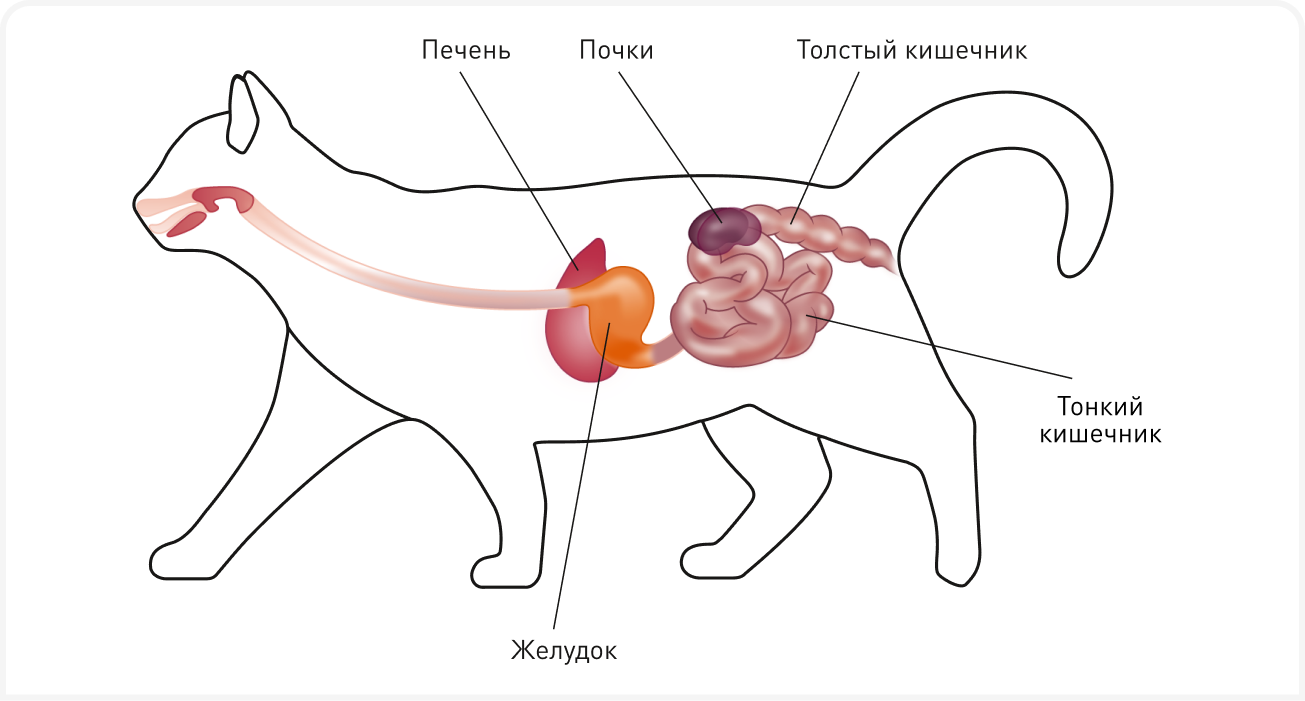
Микробиом и дисбиоз
Микробиом кишечника определяют как совокупность микроорганизмов, в основном бактерий. Эти микроорганизмы обитают в желудочно-кишечном тракте и образуют экосистему со сложным взаимодействием между собой и с хозяином. Кишечник кошек населяют триллионы кишечных бактерий из тысяч филотипов, имеющие обширные функциональные возможности. Этот широкий спектр микроорганизмов играет важную роль в поддержании здоровья хозяина, как за счет продуктов метаболизма бактерий, так и за счет влияния на экспрессию генов в кишечнике. Здоровая бактериальная микробиота и связь между хозяином и метаболитами бактерий жизненно важны для развития и поддержания здоровья иммунной системы, усвоения пищи, поддержания целостности кишечного барьера, синтеза питательных веществ (например, короткоцепочечных жирных кислот, витамина В12) и защиты от проникновения кишечных патогенов (1).
Дисбиозом называют нарушение баланса в микробном сообществе кишечника с изменением состава и метаболической активности микробиоты. При многих клинических состояниях дисбиоз — не просто маркер, а патогенетический фактор заболевания (2). Дисбиоз кишечника хорошо изучен при ХБП у человека и в лабораторных моделях; показано негативное влияние уремии на микробиом, упрощающее и более равномерно распределяющее кишечную микробиоту, в которой теперь доминируют определенные бактериальные семейства (2). Предполагаемыми причинами дисбиоза кишечника у пациентов с ХБП, помимо прямого воздействия мочевины с последующим увеличением выработки аммиака кишечными бактериями, служат частое применение антибиотиков и фосфат-связывающих средств, а также изменения диеты, такие как снижение потребления клетчатки (2).
Уремические токсины
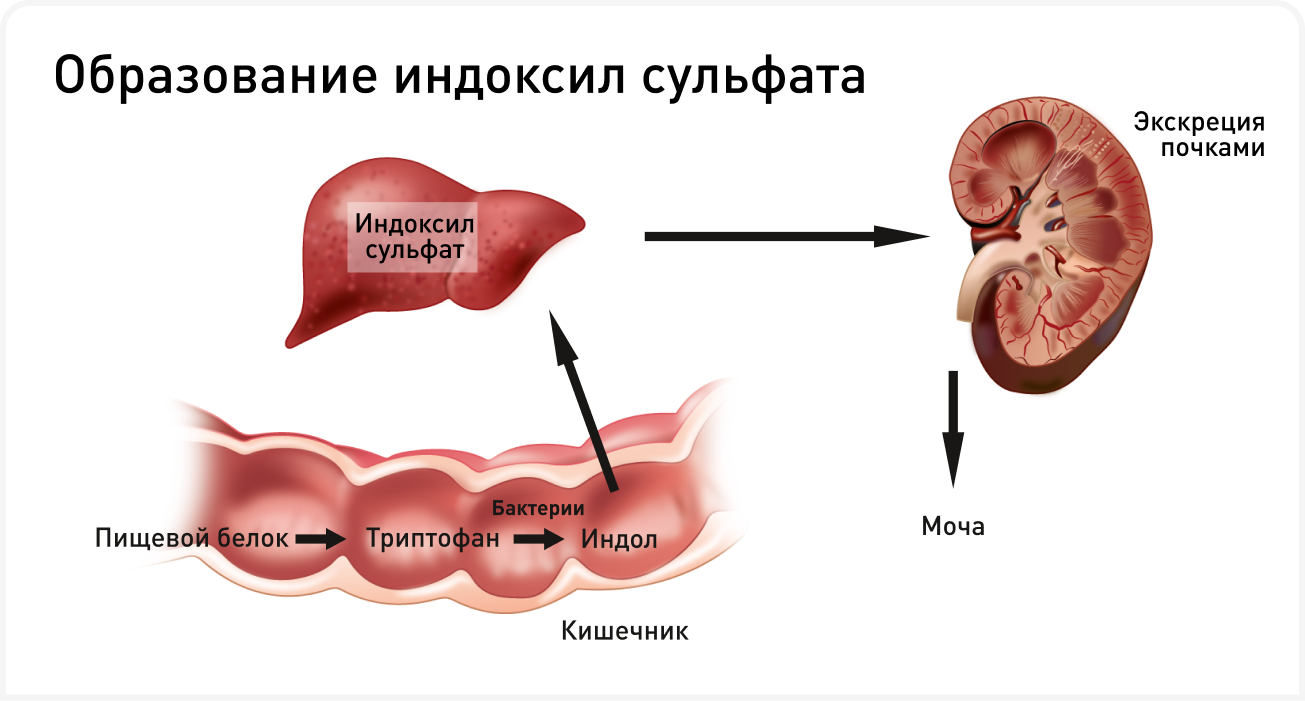
Термином «уремия» называют как накопление в крови определенных веществ в результате снижения скорости клубочковой фильтрации (СКФ), так и его клинические проявления. Обычно этим термином описывают дисбаланс электролитов, органических растворенных веществ и гормонов, но также и накопление уремических токсинов. Из уремических токсинов с клинической точки зрения наиболее известны креатинин и азот мочевины крови (АМК), но на самом деле это только два из примерно 146 органических растворенных веществ, считающихся уремическими токсинами (3). Важно отметить, что организм активно не регулирует обмен многих из этих веществ, и поэтому при снижении СКФ их концентрация постепенно повышается. Это вызывает проблемы даже в гуманной медицине, поскольку некоторые токсины не выводятся с помощью гемодиализа (3). Особый интерес представляют уремические токсины, образующиеся при катаболизме белков микробиотой толстой кишки (например, индоксил сульфат [IS], п-крезол сульфат [pCS]), поскольку считается, что они не только оказывают патофизиологически неблагоприятное действие, но и способствуют развитию клинического синдрома уремии.
Индол и п-крезол, предшественники уремических токсинов, образуются при катаболизме белков микробиотой толстой кишки (4, 5). Индолы образуются в результате метаболизма триптофана пищи под действием триптофаназы кишечной микробиоты, например, микроорганизмов Escherichia coli (E. coli), Proteus vulgaris и Bacteroides spp. (Рисунок 2). П-крезол образуется в результате частичного расщепления тирозина и фенилаланина многими облигатными или факультативными анаэробами кишечника, включая микроорганизмы родов Bacteroides, Lactobacillus, Enterobacter, Bifidobacterium и Clostridium. Индол и п-крезол всасываются, а затем сульфируются в печени с образованием связанных с белками уремических токсинов IS и pCS соответственно. Эти токсины обычно выводятся почками, поэтому у пациентов с болезнью почек накапливаются в системном кровотоке. Выработке уремических токсинов, происходящих из толстого кишечника, дополнительно способствует дисбиоз, инициируя порочный круг (4, 5). Нарушение усвоения белка в тонком кишечнике при ХБП увеличивает содержание белкового субстрата в просвете кишечника, что способствует размножению протеолитических бактерий, продуцирующих предшественники уремического токсина. Определенную роль также может играть запор, сопровождающийся длительной задержкой каловых масс в толстой кишке; у пациентов с ХБП, страдающих запорами, уровень уремических токсинов выше, чем при нормальной балльной оценке фекалий (6).
Негативное воздействие уремических токсинов
Хотя повышение концентрации вещества не подтверждает наличия болезни, известно, что многочисленные уремические токсины, которые накапливаются при ХБП, оказывают негативное воздействие. Например, накопление IS и pCS при ХБП провоцирует выработку свободных радикалов, активацию ренин-ангиотензин-альдостероновой системы (РААС), которая затем способствует развитию фиброза почек, вызывая воспаление и повреждая клетки почечных канальцев, а также стимулируя прогрессирование склероза клубочков (7). Другие нежелательные эффекты уремических токсинов также способствуют повышению заболеваемости и смертности; к ним относятся неврологические нарушения, снижение выработки эритропоэтина и регенерации костной ткани, ускоренная атрофия мышц, повышенный риск сердечно-сосудистых заболеваний (7) (Рисунок 3).
.png)
Фекальные жирные кислоты при ХБП
При дисбиозе кишечника из метаболитов микробиоты толстой кишки также могут повреждаться жирные кислоты. Короткоцепочечные жирные кислоты (КЦЖК), вырабатываемые микробиотой толстой кишки, состоят из прямоцепочечных КЦЖК — уксусной, пропионовой, масляной, валериановой и изовалериановой кислот с разветвленной цепью (BCFA) (Рисунок 4). Прямоцепочечные КЦЖК — основные конечные продукты сахаролитической ферментации сложных полисахаридов (включая неперевариваемую клетчатку пищи) и выделяемой эпителием слизи и служат незаменимыми питательными веществами, жизненно важными для здоровья как кишечника, так и организма хозяина в целом (8). Они оказывают ряд полезных местных и системных эффектов, в том числе стимулируют перистальтику толстой кишки, метаболизм липидов и глюкозы, регулируют артериальное давление и обладают противовоспалительными свойствами. Напротив, BCFA составляют лишь небольшую часть всех вырабатываемых КЦЖК и образуются, когда белок неизмененным проходит через тонкую кишку, а затем микробиота толстой кишки из состава этого белка ферментирует аминокислоты с разветвленной цепью (8).
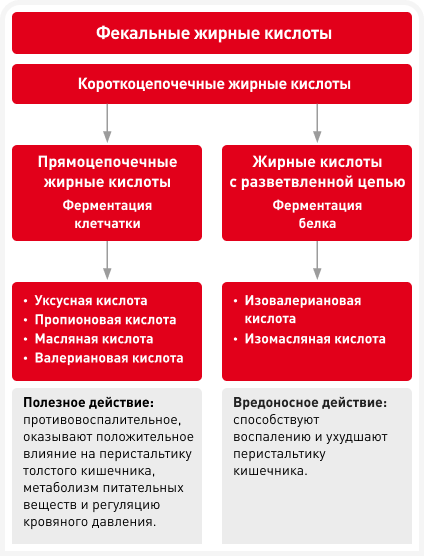
BCFA и другие продукты ферментации белка в толстой кишке считаются вредными для кишечника и могут провоцировать воспаление, а также подавлять перистальтику кишечника (8). Показано, что у человека дисбиоз при ХБП связан со снижением микробиоты, вырабатывающей КЦЖК, но BCFA, насколько известно авторам, не изучались.
.png)
Что известно про кошек?
В ветеринарии информации о микробиоме, уремических токсинах и их связи с болезнью почек относительно немного, но про кошек известно немного больше. По сравнению со здоровыми кошками (≥ 8 лет), у кошек с ХБП описан дисбиоз, характеризующийся снижением разнообразия и богатства фекальной микробиоты по данным секвенирования гена 16S рРНК (9). Кроме того, в системном кровотоке у кошек с ХБП накапливаются уремические токсины, вырабатывающиеся в кишечнике. При ХБП у кошек показано значительное повышение уровней IS (Рисунок 5) соответственно прогрессированию заболевания (10–12). В одном исследовании концентрации pCS между группами здоровых кошек и кошек с ХБП статистически значимо не различались, наиболее высокие концентрации были отмечены у кошек с ХБП (9).
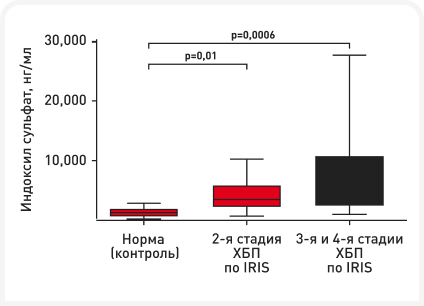
Интересно, что даже у кошек с ХБП 2-й стадии по IRIS концентрация уремических токсинов была значительно выше, чем у кошек из контрольной группы, что означает, что этот дисбаланс возникает в процессе заболевания относительно рано.
При оценке концентрации прямоцепочечных КЦЖК (уксусная, пропионовая, масляная, валериановая кислоты) и BCFA (изомасляная и изовалериановая кислоты) в фекалиях кошек с ХБП по сравнению с контрольной группой здоровых кошек было отмечено повышенное содержание изовалериановой кислоты, особенно у кошек с 3-й и 4-й стадиями ХБП по IRIS (9). У кошек с мышечной атрофией концентрации BCFA в фекалиях были выше по сравнению с кошками без мышечной атрофии. В дополнительных исследованиях было показано, что при ХБП у кошек нарушается профиль желчных кислот в фекалиях (13) и развивается дефицит нескольких незаменимых аминокислот в сыворотке крови (14). В совокупности эти данные подтверждают, что у кошек с ХБП нарушается усвоение белка, но для более полного изучения взаимодействия между кишечником и почками у этого вида животных необходимы дополнительные исследования. Тем не менее полученные данные подтверждают идею о том, что микробиом кишечника является терапевтической мишенью у кошек с ХБП, с целью снижения выработки вредных уремических токсинов и восстановления более здорового микробного сообщества в кишечнике.
Кишечник как потенциальная мишень для терапии
Уремические токсины
Из-за потенциально неблагоприятного воздействия уремических токсинов, поступающих из кишечника, и их слабого удаления при гемодиализе из‑за связывания с белками, в медицине человека основное внимание уделяют стратегиям снижения выработки IS и pCS, включая регуляцию роста микроорганизмов в толстой кишке с помощью диетического питания, пребиотиков, пробиотиков и целевой адсорбции уремических токсинов адсорбентами (4, 5). Выработку IS и pCS можно регулировать путем избирательного увеличения количества сахаролитических бактерий и уменьшения количества протеолитических бактерий в толстой кишке, а также оптимизируя время прохождения пищевого комка через кишечник (поэтому важно лечить запоры). Показано, что у человека при ХБП пребиотики и пробиотики влияют на состав микробиоты толстой кишки и снижают концентрации IS и pCS. Кроме того, показано, что увеличение содержания углеводов и клетчатки в диете и уменьшение потребления белка приводят к снижению концентрации IS и pCS.
Всасывание этих токсинов в кишечнике также ограничивают адсорбенты, такие как севеламера гидрохлорид и AST-120 (15, 16). Однако публикаций о стратегиях снижения уровня вырабатываемых в кишечнике уремических токсинов у ветеринарных пациентов с ХБП мало, и, по-видимому, необходимы дополнительные исследования возможности их применения в качестве потенциальной мишени для терапии.

Концепция уменьшения уровня уремических токсинов и клинических признаков уремии путем снижения белковой нагрузки корма — это центральная идея, которая лежит в основе модификации содержания белка в ветеринарных диетах, применяемых при болезни почек. Однако из‑за недостаточного количества исследований в настоящее время нет убедительных доказательств, что ограничение потребления белка снижает образование уремических токсинов или ослабляет клинические признаки уремии. Отсюда и недавние споры об оптимальном содержании белка в «почечных» кормах, особенно для кошек (17, 18). Имеются ограниченные данные о влиянии различного содержания белка в корме на уремические токсины у кошек. В одном исследовании на здоровых кошках корм с высоким содержанием белка (10,98 г/100 ккал МЭ против 7,44 г/100 ккал МЭ) приводил к повышенным концентрациям IS и относительно более высоким концентрациям pCS (19). Аналогичным образом, исследование на кошках с ХБП 1-й стадии по IRIS, получавших три корма с различным содержанием белка, показало у них явно более высокие концентрации IS и pCS при назначении корма с высоким содержанием белка (8,01 г/100 ккал МЭ против 6,95 г/100 ккал МЭ и 5,65 г/100 ккал МЭ) (20).
Продолжаются споры относительно оптимального содержания белка в «почечных» кормах для кошек, которые считаются облигатно плотоядными животными с повышенной потребностью в белке по сравнению с собаками и человеком. Исследования показывают, что пожилым кошкам может требоваться больше белка, чем молодым, и, кроме того, у многих кошек с ХБП масса тела, показатели кондиции тела и/или мышечной массы со временем снижаются. Принимая во внимание известную на сегодняшний день информацию, рекомендации по содержанию белка в рационе кошек с ХБП, вероятно, заключаются в точном балансировании содержания белка между ограничением выработки уремических токсинов и поддержанием мышечной массы. Ключевая концепция успеха при кормлении диетой с модифицированным содержанием белка — обеспечить адекватное потребление калорий.
У кошек с ХБП применяли пребиотические и пробиотические препараты в надежде, что они улучшат состояние кишечного микробиома и снизят в крови концентрацию уремических токсинов, поступающих из кишечника. Было изучено применение коммерческой пробиотической добавки (Enterococcus faecium SF68) у кошек с ХБП, и не было выявлено заметного влияния на микробиом кишечника и концентрацию в сыворотке крови основных уремических токсинов кишечного происхождения (21). В другом исследовании оценивалось влияние ферментируемой клетчатки (пребиотика) в составе экспериментального корма на микробиоту фекалий у кошек с ХБП, и было показано, что микробиом у них устойчив к изменениям по сравнению со здоровыми кошками (22). Клетчатка действительно снижала относительные концентрации уремических токсинов в плазме крови у кошек с ХБП по сравнению со здоровыми кошками, что подтверждает возможность снижения выработки уремических токсинов кишечного происхождения путем изменения микробиома кишечника, но стратегию, адаптированную специально для кошек, необходимо разрабатывать на основании фактических данных.
Некоторые коммерческие продукты в настоящее время доступны во многих странах; к ним относятся пробиотик/пребиотик, который, воздействуя на микробиом, формирует среду, менее активно вырабатывающую уремические токсины, и адсорбент на основе углерода, предназначенный для связывания в пищеварительном тракте индола, чтобы предотвратить его поступление в организм. Последний препарат после восьми недель приема снижал у пожилых кошек уровень индоксил сульфата (23), но данных об эффективности каких-либо препаратов для снижения концентрации IS у кошек с ХБП все еще не получено.
Запор
Распространенность запоров, связанных с ХБП у кошек, в литературе не описана, но, по-видимому, она достаточно высока (Рисунок 6). Предварительные результаты исследования характерных особенностей дефекации у кошек свидетельствуют, что при ХБП дефекация менее регулярная, и запоры, вероятно, обусловлены нарушением водного баланса и, возможно, перистальтики желудочно-кишечного тракта. Поскольку почки не могут надлежащим образом концентрировать мочу и организм борется с хроническим субклиническим обезвоживанием, из толстой кишки компенсаторно реабсорбируется вода. Также возникновению запоров могут способствовать гипокалиемия и применение фосфат-связывающих препаратов (24, 25). Терапия запоров заключается в коррекции обезвоживания и электролитного дисбаланса, увеличении содержания клетчатки в диете, применении специальных кормов, осмотических размягчителей стула или стимуляторов моторики кишечника, например лактулозы. Запор может вызывать и другие негативные клинические последствия; вероятно, его можно считать классическим примером функционирования оси кишечник — почки. Как упоминалось ранее, у пациентов с ХБП при запорах концентрация уремических токсинов выше, чем у пациентов с нормальной балльной оценкой фекалий, и наоборот, эти токсины могут отрицательно воздействовать на перистальтику желудочно-кишечного тракта (8). При лабораторном моделировании ХБП было продемонстрировано значительное снижение уровня уремических токсинов, креатинина и даже гистопатологических изменений в почках после приема лактулозы (26).
Заключение
Хотя предстоит еще много исследований, появляются все более новые доказательства взаимодействия и взаимного влияния желудочно-кишечного тракта и почек как у здоровых животных, так и при болезнях. Учитывая высокую распространенность дисбиоза в микробиоме кошек с хронической почечной недостаточностью, вполне вероятно, что для повышения продолжительности и качества жизни таких кошек основной мишенью специфичной терапии будут считать кишечник.
-
1.Sharon G, Garg N, Debelius J, et al. Specialized metabolites from the microbiome in health and disease. Cell. Metab. 2014;20:719-730.
-
2.Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora. Kidney Int. 2013;83:308-315.
-
3.Rosner M, Reis T, Husain-Syed F, et al. Classification of uremic toxins and their role in kidney failure. Clin. J. Am. Soc. Nephrol. 2021;16(12):1918-1928.
-
4.Evenepoel P, Meijers BK, Bammens BR, et al. Uremic toxins originating from colonic microbial metabolism. Kidney Int. Suppl. 2009:S12-19.
-
5.Nallu A, Sharma S, Ramezani A, et al. Gut microbiome in chronic kidney disease: challenges and opportunities. Transl. Res. 2017;179:24-37.
-
6.Ramos CI, Armani RG, Canziani ME, et al. Bowel habits and the association with uremic toxins in non-dialysis-dependent chronic kidney disease patients. J. Ren. Nutr. 2020;30(1):31-35.
-
7.Lau WL, Savoj J, Nakata MB, et al. Altered microbiome in chronic kidney disease: systemic effects of gut-derived uremic toxins. Clin. Sci. (Lond) 2018;132:509-522.
-
8.Summers S, Quimby JM, Phillips RK, et al. Preliminary evaluation of fecal fatty acid concentrations in cats with chronic kidney disease and correlation with indoxyl sulfate and p-cresol sulfate. J. Vet. Intern. Med. 2020;34:206-215.
-
9.Cheng FP, Hsieh MJ, Chou CC, et al. Detection of indoxyl sulfate levels in dogs and cats suffering from naturally occurring kidney diseases. Vet. J. 2015;205:399-403.
-
10.Chen CN, Chou CC, Tsai PSJ, et al. Plasma indoxyl sulfate concentration predicts progression of chronic kidney disease in dogs and cats. Vet J. 2018;232:33-39.
-
11.Liao YL, Chou CC, Lee YJ. The association of indoxyl sulfate with fibroblast growth factor-23 in cats with chronic kidney disease. J. Vet. Intern. Med. 2019;33:686-693.
-
12.Summers S, Quimby J, Winston J. Fecal primary and secondary bile acids in cats with chronic kidney disease. J. Vet. Int. Med. 2020;34:29-34.
-
13.Summers SC, Quimby J, Blake A, et al. Serum and fecal amino acid profiles in cats with chronic kidney disease. Vet. Sci. 2022;9(2):84.
-
14.Lin CJ, Pan CF, Chuang CK, et al. Effects of sevelamer hydrochloride on uremic toxins serum indoxyl sulfate and p-cresyl sulfate in hemodialysis patients. J. Clin. Med. Res. 2017;9:765-770.
-
15.Yamamoto S, Kazama JJ, Omori K, et al. Continuous reduction of protein-bound uraemic toxins with improved oxidative stress by using the oral charcoal adsorbent AST-120 in haemodialysis patients. Sci. Rep. 2015;5:14381.
-
16.Polzin DJ, Churchill JA. Controversies in Veterinary Nephrology: renal diets are indicated for cats with International Renal Interest Society Chronic Kidney Disease Stages 2 to 4: The Pro View. Vet. Clin. North Am. Small Anim. Pract. 2016;46:1049-1065.
-
17.Scherk MA, Laflamme DP. Controversies in Veterinary Nephrology: renal diets are indicated for cats with International Renal Interest Society Chronic Kidney Disease Stages 2 to 4: The Con View. Vet. Clin. North Am. Small Anim. Pract. 2016;46:1067-1094.
-
18.Summers S, Quimby J, Gagne J, et al. Effect of dietary protein on serum concentrations of gut-derived uremic toxins in healthy cats. J. Vet. Intern. Med. 2021;35:3069.
-
19.Ephraim E, Jewell DE. High protein consumption with controlled phosphorus level increases plasma concentration of uremic toxins in cats with early chronic kidney disease. J. Food Sci. Nutr. 2021;DOI:10.24966/FSN-1076/100096.
-
20.Summers, S. Assessment of novel causes and investigation into the gut microbiome in cats with chronic kidney disease (Publication No. 27837106) [Doctoral dissertation 2020, Colorado State University). ProQuest Dissertations & Theses Global.
-
21.Hall JA, Jackson MI, Jewell DE, et al. Chronic kidney disease in cats alters response of the plasma metabolome and fecal microbiome to dietary fiber. PLoS One 2020;15:e0235480.
-
22.Mottet J, Kowollik N. Renaltec attenuates serum levels of indoxyl sulfate in geriatic cats. In: Proceedings, BSAVA Congress, Birmingham, UK, 2019.
-
23.Benjamin SE, Drobatz KJ. Retrospective evaluation of risk factors and treatment outcome predictors in cats presenting to the emergency room for constipation. J. Feline Med. Surg. 2019:1098612X19832663.
-
24.Quimby J, Lappin M. Evaluating sucralfate as a phosphate binder in normal cats and cats with chronic kidney disease. J. Am. Anim. Hosp. Assoc. 2016;52:8-12
-
25.Sueyoshi M, Fukunaga M, Mei M, et al. Effects of lactulose on renal function and gut microbiota in adenine-induced chronic kidney disease rats. Clin. Exp. Nephrol. 2019;23:908-919.
-
26.Summers SC, Quimby JM, Isaiah A, et al. The fecal microbiome and serum concentrations of indoxyl sulfate and p-cresol sulfate in cats with chronic kidney disease. J. Vet. Intern. Med. 2019;33:662-669.




 814
814  8 мин
8 мин



.png)




.png)



