Введение
Перианальная фистула (ПАФ), также называемая анальным фурункулезом у собак — это заболевание, при котором в коже и более глубоких тканях вокруг анальной области у собак образуются свищевые каналы. У большинства пораженных животных оно протекает болезненно и изнурительно, клинические признаки варьируются от вылизывания пораженной области до кровотечений и запаха, затрудненной из-за свищей дефекации или даже непроходимости. Хотя это заболевание обнаруживается у собак разных пород, у немецких овчарок свищи встречаются чаще, что свидетельствует о генетической предрасположенности. Для сохранения качества жизни заболевших животных важно раннее распознавание и начало терапии. Крайне важное значение имеет контакт ветеринарного врача с владельцем животного, так как большинству собак для сохранения болезни в ремиссии требуется длительная поддерживающая терапия.
Этиология
С тех пор, как ПАФ был впервые описан в 1960-х годах, наши представления об этом заболевании сильно изменились. Первоначально считалось, что на его возникновение влияют анатомические факторы, такие как широкий хвост, низко посаженный хвост и повышенная плотность апокринных потовых желез в области, окружающей анальное отверстие (1). На протяжении десятилетий свищи лечились хирургическим вмешательством, начиная от ампутации хвоста, санации и ушивания свищевых ходов до удаления анального мешка.
Хотя в некоторых случаях хирургическое вмешательство и бывает необходимо, в настоящее время большинство ветеринарных врачей обычно применяют медикаментозную терапию. Этот новый подход исходит из более позднего понимания того, что это заболевание — по крайней мере частично — обусловлено нарушением функций иммунитета.
ПАФ у собак обладает многими чертами, напоминающими некоторые варианты болезни Крона у людей, включая клинические признаки, гистопатологию и реакцию на назначение циклоспорином (2–6). Считается, что болезнь Крона развивается из-за того, что иммунные клетки атакуют собственные клетки желудочно-кишечного тракта или реагируют на связанные с ним микробные антигены (7). Специфический антиген, являющийся причиной заболевания, у собак с ПАФ до сих пор не выявлен, однако предполагается, что воспаление индуцируется неадекватным иммунным ответом на нормальную микрофлору фекалий или кожи перианальной области (5). Кроме того, как и у людей, у собак была выявлена генетическая предрасположенность к развитию заболевания (8, 9): более 80% собак с диагнозом ПАФ — немецкие овчарки (10). Исследования показали, что у немецких овчарок со специфическим аллелем и гаплотипом класса II MHC (главного комплекса гистосовместимости) перианальная фистула развивается в пять раз чаще, чем у других пород (9).
Наконец, существует мнение о значимой корреляции между ПАФ, колитом и пищевой аллергией у собак (11). Таким образом, ПАФ отличается сложным многофакторным патогенезом, который, вероятно, различается у разных собак, особенно у других пород, кроме немецких овчарок.
Клинические проявления
Хотя ПАФ чаще всего встречается у немецких овчарок (по данным исследований, к этой породе относятся 84% собак, страдающих ПАФ), это заболевание также бывает у животных других пород: лабрадор-ретриверов, английских бульдогов, биглей, спаниелей, колли, бордер-колли и бобтейлов, а также у представителей смешанной породы (10). Это заболевание чаще встречается у собак среднего возраста (средний возраст манифестации составляет от четырех до семи лет), однако предрасположенность, сцепленная с полом, не выявлена (10).
Эксперт-квиз по диагностике зуда
Клинические признаки и диагностика
Диагноз ПАФ устанавливается на основании корреляции поведения животного, анамнеза, клинических признаков и результатов физикального обследования. Среди симптомов, о которых сообщают владельцы собак, страдающих ПАФ, чаще всего встречаются (10):
• болезненная дефекация;
• напряжение при дефекации;
• кровь в стуле;
• запор или непроходимость;
• понос или лентообразный стул;
• учащенная дефекация;
• гнойные выделения и/или кровотечение из перианальной области;
• вылизывание перианальной области;
• неприятный запах;
• потеря веса.
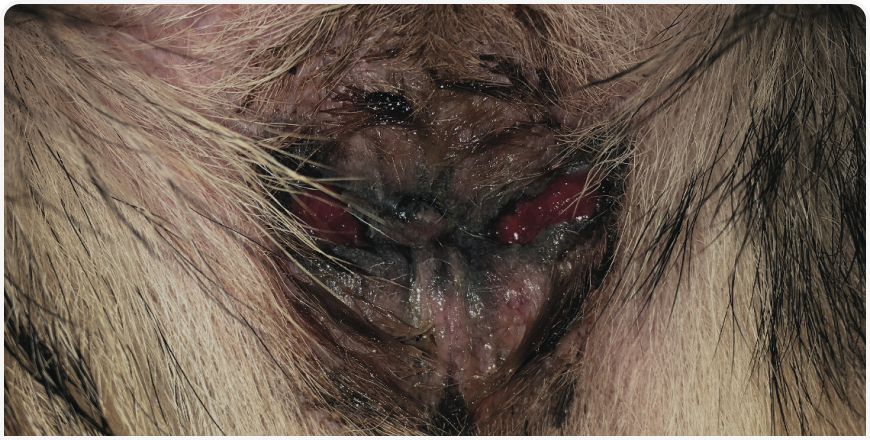
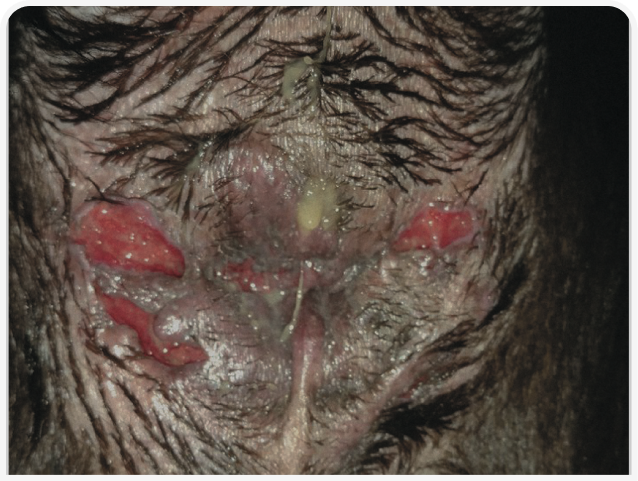
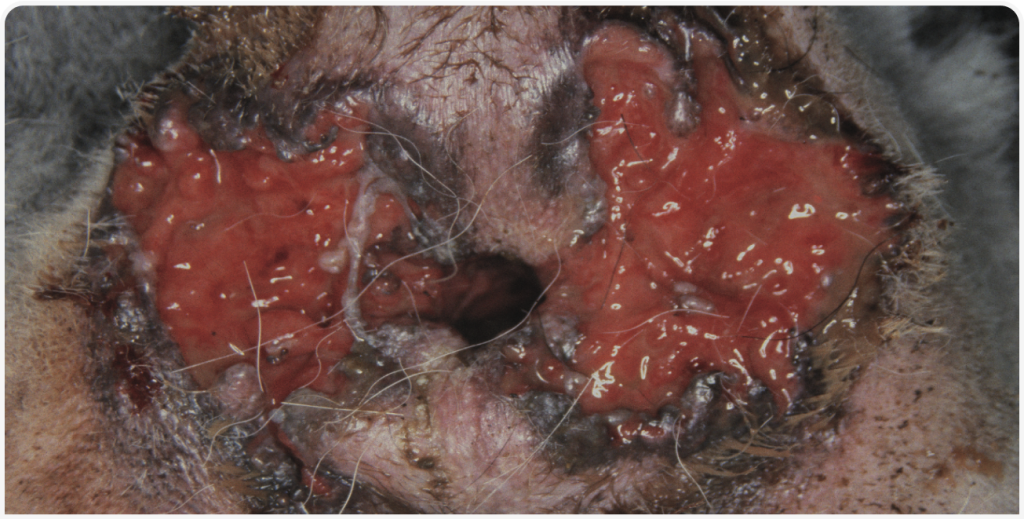
При осмотре перианальной области обычно наблюдаются множественные свищи. В тяжелых случаях они могут захватывать всю перианальную область. Обнаруживается также мокнущий дерматит и кровянисто-гнойные выделения (Рисунки 1–3).
В физикальное обследование специалист должен включать ректальное обследование. Учитывая болезненность, которой сопровождается это заболевание, для получения точной клинической оценки может потребоваться применение седативных препаратов или общая анестезия.
Очень важно правильно диагностировать ПАФ и отличить его от других сходных заболеваний:
• хронического абсцесса анального мешка с образованием вторичных свищей;
• колита;
• перианальных опухолей (в том числе аденокарциномы анального мешка);
• разъедающих поражений и/или необработанных ран от собачьих укусов (1).
Исследования показали, что у 50% пациентов с ПАФ на гистопатологии диагностировался также колит (12). Поскольку у колита и перианальной фистулы могут быть очень схожие клинические признаки, при одновременном наличии и ПАФ, и колита для окончательного определения степени заболевания может потребоваться проведение колоноскопии и биопсии. Перианальные фистулы также могут распространяться на анальный мешок. Это может повлиять на общий прогноз, так как в этих случаях лечение перианальных фистул осложняется, а частота рецидивов увеличивается. Цитологическое исследование перианальной области также может быть необходимо для выявления вторичных инфекций, например, инфицирования бактериями Staphylococcus. Если в воспалительных клетках обнаруживаются внутриклеточные бактерии, особенно диплококки, это может быть признаком вторичной бактериальной инфекции кожи, при которой необходимо применение антибактериальных препаратов.

Лечение
ПАФ — хроническое прогрессирующее воспалительное заболевание, которое со временем становится тяжелее и склонно к периодическим обострениям. Спонтанное излечение случается крайне редко, обычно для стабилизации ремиссии заболевания требуется длительная терапия (10). При перианальной фистуле используется сочетание медицинских процедур, корректировки диеты и в некоторых случаях хирургического вмешательства.
Хирургическое лечение
Хотя изначально ПАФ описывалась как анатомическая проблема, нуждающаяся в хирургической коррекции, в настоящее время основой терапевтического подхода является медикаментозное лечение. Хирургическое вмешательство обычно осуществлялось с целью удаления некротизированных тканей и разрушения эпителиальной выстилки для предотвращения рецидива и образования новых свищей, однако показатель успешности варьировался от 48 до 97% в зависимости от метода, при этом частота рецидивов приближалась к 70% (10). Часто поступали сообщения о послеоперационных осложнениях с анальным стенозом в 15% случаев и недержанием кала в 27% случаев (10).
Однако после объединения медикаментозной терапии, диетотерапии и хирургических методов в одном из исследований было зафиксировано полное или почти полное излечение перианальных фистул в 88% случаев. Почти у 80% собак исчезли клинические проявления, а у остальных 20% собак при наблюдении в течение года были зафиксированы только легкие или кратковременные клинические проявления перианальной фистулы (13). В этом исследовании 33 собаки с перианальной фистулой сначала в течение 6 месяцев получали цефалексин, метронидазол и сульфасалазин в сочетании с диетой из рыбы (с белым мясом) и картофеля, после чего было проведено хирургическое удаление свищевых ходов и двустороннее удаление анальных мешков. После операции кормление диетой с новым источником белка и углевода продолжили. Недержание кала не было зафиксировано ни у одной из собак.
Также при этом сочетании медикаментозных и хирургических методов наблюдалось в целом меньше осложнений, чем ранее при оперативном лечении. Однако предпочтительным вариантом при ПАФ, с учетом современного понимания ее этиологии и высокой частоты рецидивов и потенциально серьезных осложнений, наблюдаемых в некоторых случаях хирургических вмешательств, я считаю медикаментозную терапию с использованием иммунодепрессантов или иммуномодуляторов. Однако в случаях перианальных фистул с сопутствующим саккулитом анальной железы, либо при сообщении свищевого хода с анальным мешком (Рисунки 4 и 5), если одна лишь медикаментозная терапия окажется неэффективной, может потребоваться хирургическое вмешательство для удаления пораженного анального мешка. Такие случаи встречаются нечасто, однако могут быть значимой причиной рецидивирующего ПАФ. В этих случаях обычно требуется удаление анальных мешков.
Медикаментозное лечение
Поскольку существуют предположения об иммунологической этиологии ПАФ, а также сходство с ее аналогом у людей (болезнью Крона), применение иммуносупрессивной или иммуномодулирующей терапии в качестве основного средства выглядит перспективным. Поскольку ПАФ является хроническим пожизненным заболеванием, первая фаза терапии может считаться фазой индукции ответа. На этой стадии ветеринарный врач продолжает ее до тех пор, пока не удастся добиться полной или почти полной ремиссии заболевания и снижения выраженности клинических признаков. Затем специалист начинает вторую фазу терапии, на которой применяются поддерживающие препараты, позволяющие поддерживать ремиссию заболевания в течение длительного времени. В число препаратов, наиболее часто используемых в фазе индукции, входят циклоспорин (с добавлением кетоконазола или без него), глюкокортикоиды, азатиоприн и такролимус (местно).
Я не считаю преднизон в иммуносупресивной дозировке (начиная с 2 мг/кг каждые 24 часа) предпочтительным препаратом для монотерапии, так как в литературных источниках есть данные о его низкой эффективности. Полное излечение преднизоном было достигнуто для 33% пациентов, частичная ремиссия — только у 33% (10). Еще один иммунодепрессант, азатиоприн, также с умеренным успехом используется в лечении ПАФ. Учитывая период отставания в несколько недель, необходимый для достижения оптимального уровня азатиоприна в крови, во время фазы индукции рекомендуется одновременное применение преднизона. Индукционная доза азатиоприна, необходимая для достижения ремиссии, составляет 2 мг/кг каждые 24 часа, после чего доза снижается до 2 мг/кг каждые 48 часов, а затем может быть снижена до поддерживающей дозы 1 мг/кг каждые 48 часов. Полная или частичная ремиссия была зарегистрирована у 64% из 14 собак, получавших азатиоприн и преднизон (14).
При использовании азатиоприна необходимо проведение лабораторного мониторинга, включая полный анализ крови и биохимию сыворотки, чтобы не допустить развитие миелосупрессии и интоксикации печени. В недавнем исследовании изучалось применение мофетила микофенолата для лечения ПАФ у одной собаки.

«
«Хотя изначально перианальная фистула описывалась как анатомическая проблема, требующая хирургической коррекции, в настоящее время основой терапевтического подхода является медикаментозное лечение».

Мофетила микофенолат представляет собой лимфоцитарный иммунодепрессант, который применяется для лечения широкого спектра иммуноопосредованных заболеваний, однако в этом одном изучаемом случае его применение в течение 4 недель не помогло добиться ремиссии (15).
Наиболее эффективным препаратом для лечения ПАФ (и моим препаратом выбора) является циклоспорин. Это ингибитор кальциневрина, который ингибирует транскрипцию IL-2, тем самым предотвращая активацию и пролиферацию Т-лимфоцитов. Считается, что иммуномодулирующее действие этого препарата затрагивает иммунную дисфункцию, предположительно являющуюся причиной ПАФ (16). По данным нескольких исследований, в которых сообщается об исчезновении клинических признаков и полной клинической ремиссии ПАФ, все клинические признаки исчезли у 69–100% собак, получавших циклоспорин, при этом полная ремиссия наблюдалась у 69–93% собак (17–20). Однако в некоторых из этих исследований авторы сообщают о рецидивах примерно в 50% случаев при прекращении лечения циклоспорином (17, 20).
Основополагающая иммуноопосредованная этиология и высокая частота рецидивов говорят о том, что для лечения ПАФ необходима постоянная поддерживающая терапия. При использовании циклоспорина в качестве монотерапии первоначальные дозы варьируются от 4–8 мг/кг каждые 24 часа. Эти дозы применяются до тех пор, пока поражения не перейдут в состояние ремиссии (11, 21). Заметное клиническое улучшение наблюдается всего через две недели после начала терапии (17).
Когда все поражения перейдут в состояние ремиссии, дозировку циклоспорина можно снизить до поддерживающей. Я предпочитаю поддерживать постоянную общую суточную дозу и уменьшать количество дней в неделю, в которые собаке дается лекарство. Конечной целью является окончательное прекращение приема циклоспорина в течение трех-шести месяцев с одновременным введением такролимуса в качестве поддерживающей терапии (Вставка 1). Хотя некоторым пациентам может по-прежнему требоваться применение циклоспорина, большинство из них нормально переносит некоторое снижение дозы. Корреляции между концентрациями циклоспорина и эффективностью лечения ПАФ не выявлено, поэтому в настоящее время регулярный мониторинг содержания циклоспорина в крови не требуется (16).
Наиболее частыми побочными эффектами циклоспорина являются расстройства желудочно-кишечного тракта (ЖКТ) (отсутствие аппетита, рвота, мягкий стул или диарея), а также развитие хронических побочных эффектов, в том числе гипертрофического гингивита и гирсутизма. В более редких случаях в качестве побочных эффектов были зафиксированы папилломатоз, атипичные бактериальные или грибковые инфекции и псориазоподобный дерматит.
Поскольку циклоспорин стоит довольно много, а большинство собак, страдающих ПАФ, относятся к крупным породам, которым требуются более высокие дозы, для уменьшения дозы циклоспорина можно добавлять кетоконазол. Кетоконазол конкурентно ингибирует фермент цитохром P450 3A, что приводит к увеличению периода полувыведения циклоспорина из крови и повышению уровня препарата в крови (22). Протокол дозирования для комбинированной терапии циклоспорином и кетоконазолом рекомендует дозировку циклоспорина от 0,5 мг/кг каждые 12 часов до 5 мг/кг каждые 24 часа, дозировку кетоконазола — от 5 до 7,5 мг/кг каждые 12–24 часа (11, 22). В настоящее время препаратом первого выбора для фазы индукции я считаю циклоспорин, начиная с дозы 2,5 мг/кг каждые 24 часа в сочетании с кетоконазолом в дозировке 7,5 мг/кг каждые 24 часа. По моим оценкам, такой комбинированный протокол снижает стоимость лечения по сравнению с лечением одним только циклоспорином до 70%, не снижая при этом эффективности (21).
Кетоконазол также может вызывать расстройство ЖКТ, в более редких случаях оказывать токсическое действие на печень, вызывать тромбоцитопению или кожные реакции, в том числе зуд и алопецию.
Такролимус является местным ингибитором кальциневрина с аналогичным циклоспорину иммуномодулирующим действием. Он может применяться в монотерапии легких случаев ПАФ (Рисунок 1). В одном исследовании, где изучалось применение такролимуса в качестве монотерапии, сообщалось о клинической ремиссии у 50% собак и существенного снижения выраженности клинических признаков у 90% пациентов. Однако, как это часто бывает при ПАФ, примерно в 50% случаев после прекращения терапии наблюдался рецидив (23).
В другом исследовании изучалось использование такролимуса в сочетании с преднизоном, диетой с новым источником белка и кратким курсом метронидазола. По сообщениям авторов, у 87% собак удалось добиться полного исчезновения симптомов без рецидива в течение двухлетнего периода (24). Схема лечения, используемая в этом исследовании, включала прием такролимуса каждые 7 дней, при этом 73% собак также получали диету с новым источником белка, а 33% собак получали преднизон каждые 48 часов (24).
Я считаю, что такролимус можно использовать для лечения легких случаев ПАФ (начиная с приема дважды в сутки), однако он также хорошо подходит для применения в качестве долгосрочной поддерживающей терапии (прием каждые 24–72 часа), позволяющей предотвратить обострение клинических признаков и рецидив фистулы. Когда в результате перорального приема иммуномодулирующих препаратов (циклоспорина и кетоконазола) проявление клинических признаков снизилось, можно начинать поддерживающую терапию и рекомендовать владельцу собаки местное лечение перианальной области.
В настоящее время разрабатываются новые методы терапии ПАФ. В нескольких недавних клинических исследованиях, проведенных на людях, изучалось использование мезенхимальных стволовых клеток для лечения свищей при болезни Крона. Исследование дало положительные результаты.
В небольшом пилотном исследовании шести собакам, страдающим трудно поддающейся лечению ПАФ, вводилась однократная инъекция мезенхимальных стволовых клеток, полученных из эмбриональных стволовых клеток. Спустя три месяца после инъекции у всех шести собак отсутствовали клинические признаки, включая свищи, однако у двух собак через шесть месяцев после лечения был зафиксирован рецидив (25). В настоящее время этот метод лечения все еще находится на стадии исследования и недоступен для клинического применения.
Диетотерапия
Поскольку существует вероятность взаимосвязи ПАФ, колита и пищевой аллергии у некоторых собак, при лечении может оказаться полезной элиминационная диета с содержанием гидролизованных белков (11). В ретроспективном исследовании, в котором исследовались нежелательные реакции на корм с дерматологическими проявлениями, было установлено, что, хотя у 100% собак с такими реакциями возникает зуд, у 3 из 16 собак также развилась ПАФ. Все три собаки с ПАФ были немецкими овчарками, поэтому, хотя эти данные нельзя экстраполировать на другие породы, можно предположить взаимосвязь ПАФ и пищевой аллергии у этой породы.
Роль нежелательной реакции на корм в патогенезе ПАФ, как говорилось выше, подтверждается тем фактом, что смена рациона на диету с новым источником белка белком приводила к снижению частоты рецидивов после хирургического удаления пораженных тканей и двустороннего удаления анальных мешков (13).
Снижение частоты рецидивов расценивается как следствие применения диеты с новым источником белка. Поскольку лекарственные препараты, такие как циклоспорин, могут вызвать расстройство ЖКТ, я обычно рекомендую во время фазы поддерживающей терапии перевести собаку на диету с новым источником белка. Тогда животному требуется меньше перорально принимаемых препаратов. Я особенно рекомендую владельцу попробовать эту диету, если у собаки также наблюдаются другие признаки пищевой аллергии (например, зуд), а также при развитии рецидива поражений при постепенном снижении дозы перорально принимаемых препаратов или при внезапном обострении на фоне приема низких доз поддерживающих препаратов. Я рекомендую для проверки перевести животное на диету с новым источником белка или гидролизатом белка по меньшей мере на 8 недель.
Антибактериальная терапия
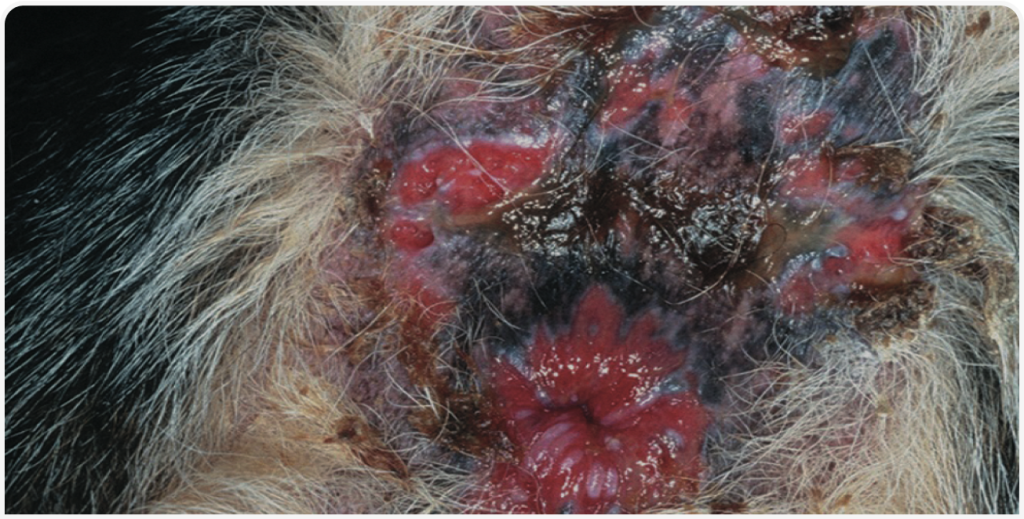
Вторичные бактериальные инфекционные поражения кожи часто встречаются при ПАФ (Рисунок 6). Хорошие результаты в лечении и/или профилактике бактериального инфицирования кожи дает местная обработка для поддержания чистоты перианальной области. Она может включать выстригание лишней шерсти, использование местных антисептиков для очистки этой области, а также применение местных антибактериальных препаратов.
В зависимости от тяжести инфекции, в некоторых случаях также может понадобиться пероральный прием антибиотиков. Я предпочитаю для эмпирической антибактериальной терапии применять либо цефалексин (22–30 мг/кг каждые 12 часов), либо цефподоксим (5–10 мг/кг каждые 24 часа), однако хорошим выбором может также оказаться применение метронидазола (10–15 мг/кг каждые 12 часов) или комплекса амоксициллина с клавулановой кислотой (14,5–22 мг/кг каждые 12 часов). При инфекции, устойчивой к эмпирическим антибиотикам, рекомендуется провести посев культуры и тестирование на восприимчивость. Я также полагаю, что дополнительная терапия антибиотиками с мупироцином или сульфадиазином серебра может применяться до тех пор, пока пациент переносит применение этих препаратов.
-
1.DeNovo RC, Bright RM. Recto-anal Disease. In: Ettinger SJ, Feldman EC (eds.) Textbook of Veterinary Internal Medicine 5th ed. St. Louis: Elsevier Saunders, 2000;1264-1266.
-
2.Day MJ, Weaver BM. Pathology of surgically resected tissue from 305 cases of anal furunculosis in the dog. J Small Anim Pract 1992;33: 583-589.
-
3.House A, Gregory SO, Catchpole B. Expression of cytokine mRNA in canine anal furunculosis lesions. Vet Rec 2003;153:354-358.
-
4.Mullin GE, Lazenby AJ, Harris ML, et al. Increased interleukin-2 messenger RNA in the intestinal mucosal lesions of Crohn’s disease but not ulcerative colitis. Gastroenterology 1992;102:1620-1627.
-
5.Tivers MS, Catchpole B, Gregory S, et al. Interleukin-2 and interferon-gamma mRNA expression in canine anal furunculosis lesions and the effects of cyclosporine therapy. Vet Immunol Immunopathol 2008;125:31-35.
-
6.Matthews KA, Sukhiani HR. Randomized controlled trial of cyclosporine for treatment of perianal fistulas in dogs. J Am Vet Med Assoc 1997;211:1249-1253.
-
7.Boyapati R, Satsangi J, Ho GT. Pathogenesis of Crohn’s disease. F1000Prime Rep 2015;7:44.
-
8.Massey J, Short AD, Catchpole B, et al. Genetics of canine anal furunculosis. Immunogenetics 2014;66:311-324.
-
9.Kennedy LJ, O’Neill T, House A, et al. Risk of anal furunculosis in German Shepherd dogs is associated with the major histocompatibility complex. Tissue Antigens 2007;71:51-56.
-
10.Patterson AP and Campbell KL. Managing anal furunculosis in dogs. Comp Cont Educ Practicing Vet 2005;27:339-355.
-
11.Proverbio D, Perego R, Spada E, et al. Prevalence of adverse food reactions in 130 dogs in Italy with dermatological signs: a retrospective study. J Small Anim Pract 2010;51:370-374.
-
12.Jamieson PM, Simpson JW, Kirby BM, et al. Association between anal furunculosis and colitis in the dog: preliminary observations. J Small Anim Pract 2002;43:109-114.
-
13.Lombardi RL and Marino DJ. Long-term evaluation of canine perianal fistula disease treated with exclusive fish and potato diet and surgical excision. J Am Anim Hosp Assoc 2008;44:302-307.
-
14.Harkin KR, Phillips D, Wilkerson M. Evaluation of azathioprine on lesion severity and lymphocyte blastogenesis in dogs with perianal fistulas. J Am Anim Hosp Assoc 2007;43:21-26.
-
15.Ackermann AL, May ER, Frank LA. Use of mycophenolate mofetil to treat immune-mediated skin diseases in 14 dogs. Vet Dermatol 2017;28:195-199.
-
16.Guagère E, Steffan J, Olivry T. Cyclosporine A: a new drug in the field of canine dermatology. Vet Dermatol 2004;15:61-74.
-
17.Klein A, Deneuche A, Fayolle P, et al. Preoperative immunosuppressive therapy and surgery as a treatment for anal furunculosis. Vet Surg 2006;35:759-768.
-
18.Mouatt JG. Cyclosporine and ketoconazole interaction for treatment of perianal fistulas in dogs. Aust Vet J 2002;80:207-211.
-
19.Patricelli AJ, Hardie RJ, McAnulty JF. Cyclosporine and ketoconazole for the treatment of perianal fistulas in dogs. J Am Vet Med Assoc 2002;220:1009-1016.
-
20.Doust R, Griffith LK, Sullivan M. Evaluation of once-daily treatment with cyclosporine for anal furunculosis in dogs. Vet Rec 2003;152:225-229.
-
21.Hardie RJ, Gregory SP, Tomlin J, et al. Cyclosporine treatment of anal furunculosis in 26 dogs. J Small Anim Pract 2005;46:3-9.
-
22.O’Neill T, Edwards GA, Holloway S. Efficacy of combined cyclosporine A and ketoconazole treatment of anal furunculosis. J Small Anim Pract 2004;45:238-243.
-
23.Misseghers BS, Binnington AG, Mathews KA. Clinical observations of the treatment of canine perianal fistulas with topical tacrolimus in 10 dogs. Can Vet J 2000;41:623-627.
-
24.Stanley B and Hauptman J. Long-term prospective evaluation of topically applied 0.1% tacrolimus ointment for treatment of perianal sinuses in dogs. J Am Vet Med Assoc 2009;235:397-404.
-
25.Ferrer L, Kimbrel EA, Lam A, et al. Treatment of perianal fistulas with human embryonic stem cell-derived mesenchymal stem cells: a canine model of human fistulizing Crohn’s disease. Regen Med 2016;11:33-43.





 13201
13201  7 мин
7 мин







