Введение
Атопический дерматит собак (CAD) — распространенное воспалительное заболевание кожи, поражающее до 15% мировой популяции собак (1). Патогенез заболевания многофакторный, при этом известно, что центральную роль в нем играют дисфункция кожного барьера и нарушение иммунной регуляции, на которые, в свою очередь, могут влиять как генетические факторы, так и факторы окружающей среды. Контакт с аллергенами запускает ряд ключевых иммунопатологических IgE- и не-IgE-опосредованных процессов (2).
Из лабораторных показателей при CAD чаще всего выявляют повышение уровня аллерген-специфического IgE в сыворотке крови, но (в отличие от человека) повышенный уровень общего IgE в диагностике CAD не имеет диагностической ценности. У собак уровень IgE намного выше, чем у человека; вероятно, это связано с более частыми случаями инфестации паразитами (3). Известны два основных фактора риска развития атопического дерматита: породная предрасположенность (например, CAD поражает до 50% вест-хайленд-уайт-терьеров) и наличие заболевания в семейном анамнезе (4).
Однако поскольку в процесс вовлечены как генетические факторы, так и факторы окружающей среды, внешние проявления заболевания очень разнообразны, причем различаются они не только между породами, но и у отдельных собак одной породы. CAD — многофакторное заболевание с множеством аспектов; кроме того, другие кожные заболевания могут иметь сходные клинические признаки, поэтому постановка точного диагноза становится сложной задачей.
Диагностика
В настоящее время надежных биомаркеров для дифференциации CAD с другими дерматологическими заболеваниями не существует, поэтому диагноз CAD остается клиническим – это означает, что врачу приходится интерпретировать и учитывать различные аспекты, включая историю болезни пациента и характерные симптомы, и исключать другие возможные кожные заболевания.
На Рисунке 1 представлен процесс диагностики CAD. Вначале исключают другие заболевания, схожие по клиническим признакам с CAD. Хотя зуд обнаруживается часто, он характерен не только лишь для CAD, поэтому следует дифференцировать другие заболевания.

На этапе первичного обследования на основании клинических проявлений, анамнеза или дополнительных специализированных тестов (Таблица 1) исключают инфестации эктопаразитами и бактериальные или дрожжевые инфекции на фоне не вызывающих зуда заболеваний (например, эндокринопатии, аденит сальных желез) или, реже, опухолей (например, лимфома кожи, которая чаще встречается у пожилых животных).
.png)
Следует отметить один из признаков, характерных для CAD, который может наблюдаться в начале заболевания: зуд может не сопровождаться видимым поражением кожи или возникать на фоне первичных поражений кожи, например эритемы или папул. С течением времени и присоединением вторичных инфекций могут развиться пустулы, алопеция, экскориации, лихенификация, образование корочек, себорея. Поражения у большинства собак развиваются на морде, внутренней стороне ушных раковин, в подмышечных впадинах, в брюшной, паховой и/или промежностной области (Рисунок 2), хотя у собак разных пород могут поражаться разные участки тела (5).
.png)
После исключения других возможных причин проводят оценку клинических признаков с помощью стандартизированных клинических критериев диагностики CAD по Фавро (Таблица 2). Ранее проводить оценку по Фавро не рекомендуется, так как, хотя в случае соответствия пяти из этих критериев CAD будет выявлен у 80% собак, у остальных 20% зуд будет вызван другим заболеванием. И наоборот, около 20% собак, действительно страдающих CAD, не будут соответствовать даже пяти из этих критериев.
.png)
Тестирование на аллергены окружающей среды
После клинической диагностики CAD показано дальнейшее обследование собаки, особенно для определения аллергенов, усиливающих клинические проявления. Это позволит понять, каких аллергенов следует избегать (особенно в отношении пищевых аллергенов, хотя некоторые меры могут быть приняты и в отношении клещей домашней пыли), и подобрать аллергены для аллерген-специфической иммунотерапии.
В целом при сезонном характере CAD у собаки необходимо безотлагательное выявление аллергенов окружающей среды, но при круглогодичном зуде и/или желудочно-кишечных симптомах следует в первую очередь исключить нежелательные пищевые реакции и только после этого проводить поиск внешних причин зуда. Автор часто начинает лечение с промышленной диеты на основе гидролизованного белка по протоколу элиминационной диеты.
Если симптомы CAD при этом сохраняются, следует провести тестирование на аллергены окружающей среды в виде кожных проб in vivo (чаще всего внутрикожных — IDT) либо серологического исследования на аллерген-специфические IgE in vitro (ASIS).
Помимо слабой реакции на элиминационное исследование, к проведению аллергодиагностики могут побудить тяжелые клинические проявления на протяжении более трех месяцев в году или неэффективность симптоматической терапии (в том числе при значительных побочных эффектах на лекарственные препараты либо недостаточном соблюдении режима лечения владельцем) (6).
Следует подчеркнуть, что ни IDT, ни ASIS не предназначены для скринингового обследования на CAD; они лишь помогают подтвердить клинический диагноз и выявить аллергены. У большинства собак с CAD при тестировании выявляют аллерген-специфический IgE к аллергенам окружающей среды, хотя в некоторых случаях уровень IgE не повышен («неатопический дерматит»).
Оба теста имеют свои недостатки и преимущества и примерно эквивалентны, а поскольку они одинаково влияют на эффективность аллерген-специфической иммунотерапии (ASIT) (7), их можно рассматривать как взаимодополняющие. Автор предпочитает проводить и кожное тестирование, и ASIS, если позволяют средства; однако если первый метод сопровождается потенциальным риском или проведение проб представляет трудность в связи с неконтактностью пациента, в качестве первоначального метода диагностики выбирают ASIS. Если результаты обоих методов тестирования неоднозначны, решение о проведении ASIT принимают по общему результату, в противном случае выбор в пользу ASIT обычно основывают на результатах ASIS.
Важно отметить, что для каждого метода необходимо выбирать клинически значимые аллергены, что в значительной степени зависит от анамнеза пациента и суждения врача.
Кроме того, в последнее время снова получила распространение кожная скарификационная проба, эффективность ее применения в ветеринарии пока не подтверждена исследованиями. Также на рынке появился анализ на аллергены в образце слюны, но на момент написания статьи он не может быть рекомендован в качестве диагностического метода.
Внутрикожное тестирование (IDT)
IDT — косвенный показатель кожной реактивности тучных клеток, основанный на присутствии на их поверхности аллерген-специфических IgE. Этот метод является предпочтительным среди дерматологов, отчасти потому, что тучные клетки могут связывать отдельные молекулы аллерген-специфических IgE в течение более года (8). Данных о чувствительности и специфичности IDT немного; по опубликованным отчетам они достигают 30-90% и > 50-95% соответственно (6, 9). Однако точная оценка очень сложна из-за большого количества как внутренних (например, иммунологический статус пациента), так и внешних факторов (например, качество аллергена, уровень квалификации при проведении IDT, сезон, лекарственные препараты).
Выбор аллергена
Для выбора наиболее подходящих аллергенов для проведения IDT нужно учитывать географическую локацию животного; можно запросить информацию в специализированных ветеринарных и человеческих клиниках, аллергологических лабораториях, других соответствующих организациях.
Тем не менее выбранные аллергены следует периодически пересматривать, по мере необходимости исключая или включая некоторые из них. Например, у автора первоначальная панель исследований IDT ранее состояла из 43, а затем была сокращена до наиболее часто встречающихся 13 внешних аллергенов (Блок 1) и приведена в соответствие с панелью, используемой в местной гуманной дерматологической клинике. За семилетний период эта пересмотренная панель не показала снижения эффективности ASIT.
.png)
При IDT можно использовать лиофилизированные или предварительно разведенные водные растворы аллергенов, предназначенные для иммунотерапии (срок хранения которых обычно составляет не менее 6-12 месяцев), с дальнейшим разведением аллергенов, как указано в Таблице 3.
Они остаются стабильными на протяжении до 2 недель при хранении при температуре 4°C в пластиковых шприцах или до 8 недель при хранении в стеклянных флаконах, но содержание аллергена в экстракте снижается со временем (9), разбавлением и повышением температуры. Следует избегать обработанных глицерином аллергенов (обычно используемых для кожной скарификационной пробы у человека) из-за возможного раздражающего действия консерванта глицерина.
.png)
Методология
Единственная имеющаяся в настоящее время рекомендация по оптимальному времени проведения IDT у собак с сезонным заболеванием заключается в проведении теста в конце или в течение 2 месяцев пикового сезона (10); это позволяет избежать возможного отсутствия кожной реакции в пиковый сезон или низких уровней IgE вне сезона, хотя у некоторых собак реакция при IDT может оказаться достаточной и в пиковый сезон. Собакам с несезонным заболеванием можно проводить анализ в любое время года.
IDT можно проводить без седации, в положении стоя (предпочитаемый автором вариант) или лежа на боку. Считается, что некоторые седативные препараты (например, оксиморфон, кетамин/диазепам, ацепромазин и морфин) влияют на результаты IDT негативно и их применения следует по возможности избегать, в то время как другие (например, ксилазина гидрохлорид, медетомидин (дексмедетомидин), тилетамин/золазепам, тиамилал, галотан, изофлуран и метоксифлуран) использовать безопасно (6).
Рекомендации по использованию пропофола для IDT противоречивы, поэтому в настоящее время его применение не рекомендуется. Важно также учитывать время выведения некоторых препаратов (сохранение которых в организме может привести к ложноотрицательным результатам) (Таблица 4).
.png)
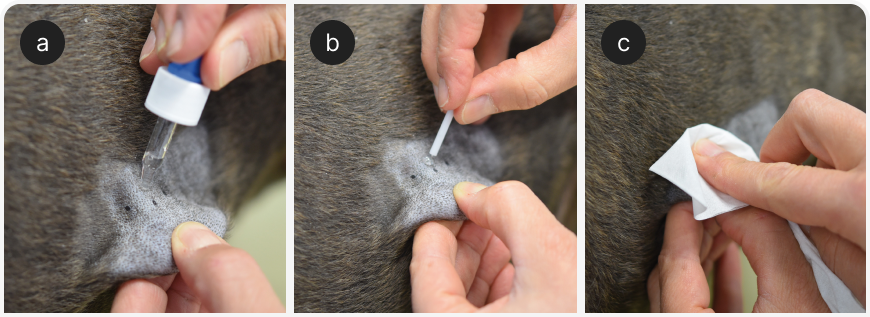
Участок кожи (обычно боковую поверхность грудной клетки) аккуратно выбривают (размер области подбирают в зависимости от количества используемых аллергенов), но не вытирают и не моют. Отдельные участки для тестирования помечают водостойким маркером на расстоянии не менее 2 см друг от друга и внутрикожно вводят небольшой объем (обычно 0,05 мл) каждого тестируемого раствора (Рисунок 3a).
На коже должен появиться волдырь; если его нет, аллерген был введен слишком глубоко (подкожно) и инъекцию следует повторить.
Реакцию оценивают через 15-20 минут, при этом все высыпания и эритемы на каждом участке сравнивают с положительным и отрицательным контролем (Рисунок 3b) и оценивают по шкале от 0 (равно отрицательному контролю) до 4 (равно положительному контролю) баллов. Любую реакцию на уровне 2 или более баллов считают положительной. Хотя оценку можно провести и объективными методами (измерив диаметр реакции), определенного преимущества этого варианта не выявлено (6), и автор предпочитает оценивать реакцию субъективно.
Побочные реакции на тест встречаются редко; если они и возникают, то преимущественно во время самой процедуры, обычно в виде интенсивного зуда в месте инъекции (местная реакция гиперчувствительности), который можно облегчить коротким курсом местных глюкокортикоидов или системным противовоспалительным или противозудным лечением. В редких случаях могут развиться другие явления, такие как анафилаксия (генерализованный зуд, рвота, диарея или даже коллапс), которые требуют соответствующего лечения.
.png)
Эксперт-квиз по диагностике зуда
Серологическое исследование на аллерген-специфические IgE (ASIS)
ASIS широко используют in vitro в ветеринарии благодаря ряду преимуществ перед IDT. К ним относятся исключение опасного для жизни пациента риска (связанного с седацией или анафилактическими реакциями), удобство (отсутствие необходимости выстригать шерсть и фиксировать животное, короткая продолжительность процедуры) и меньшая вероятность того, что на результаты отрицательно повлияет предшествующая или текущая лекарственная терапия (9).
Существуют различные тесты, например твердофазные радиоаллергосорбентный тест, RAST, или ИФА (последний используют чаще всего) и жидкофазный иммуноферментный анализ (9). При первичном внедрении в практику у этих IgE-тестов был выявлен ряд недостатков, особенно низкая специфичность.

Ряд усовершенствований, в том числе разработка соответствующих реагентов для выявления IgE к аллергенам собак, повысили их диагностическую точность (11).
Другими ограничениями ASIS являются потенциальная меж- и внутрилабораторная вариабельность и перекрестная реактивность (12). Более того, последние данные показывают, что частично причиной ложноположительных результатов, особенно в отношении пыльцы, может быть наличие IgE-антител против перекрестно реагирующих углеводных детерминант (анти-CCD-антитела) (13).
Блокирование анти-CCD-антител привело к значительному улучшению корреляции результатов IDT и ASIS у собак (12) и заметному снижению частоты положительных реакций на пыльцевые аллергены у кошек (14). Клинически значимо, что результаты ASIT не зависят от выбора методики ASIS (9), и, как отмечалось выше, эффективность ASIT сопоставима независимо от того, основывается ли выбор аллергенов на результатах IDT или ASIS. В связи с этим ASIS может быть предпочтительным диагностическим методом для врачей первичного звена в случаях, когда проведение IDT невозможно ни в клинике, ни путем направления пациента в специализированный центр.
Другие варианты тестирования
У человека для выявления гиперчувствительности I типа при атопическом дерматите методом выбора считают кожную скарификационную пробу, и для этого есть несколько причин: низкая стоимость аллергена (обработанные глицерином аллергены, как правило, сохраняют стабильность на протяжении долгого периода времени), быстрая интерпретация результатов, отсутствие побочных эффектов, высокая специфичность (15).
Считается также, что этот метод отличается значительно меньшей болезненностью. Проведение кожной скарификационной пробы в ветеринарной аллергологии было описано еще в 1990-х годах (16), но отчет об этом случае показал, что в интерпретации результатов метод уступает IDT, и дальнейших попыток внедрить этот тест в клиническую практику не предпринималось.
Однако в последние несколько лет вновь появился клинический и научный интерес к оценке преимуществ применения этого диагностического метода у собак и кошек. В одном исследовании тест с использованием восьми различных аллергенов окружающей среды проводили 20 здоровым собакам (17), при этом не было отмечено признаков боли или дискомфорта, процедура была простой (заняла в среднем 5 минут, включая выстригание шерсти и введение аллергена).
Выраженность положительной реакции составила 3-12 мм (медиана 9 мм), однако в этом исследовании оценивались только пороговые значения для здоровых собак. В аналогичном исследовании оценивалась чувствительность и специфичность этого метода в отношении одиннадцати распространенных аллергенов окружающей среды на собаках без аллергии и собаках со спонтанным атопическим дерматитом (18). Чувствительность была установлена равной 66% (аллергены были выявлены у трех из пяти собак, ложноотрицательные результаты получены у двух других собак), а специфичность — 100% (ни у одной собаки не выявлено ложноположительных результатов).
Хотя кожная скарификационная проба еще не признана в ветеринарной аллергологии, эти исследования позволяют предположить, что в будущем она может стать практичным и точным методом для дополнительной диагностики CAD. В настоящее время автор использует этот тест в основном для верификации тяжелых реакций гиперчувствительности на яд Hymenoptera (например, пчел и ос) (19), процедура показана на Рисунке 4.
Наконец, в некоторых странах в настоящее время появился ряд методов диагностики нежелательной пищевой реакции (НПР) и/или аллергии на факторы окружающей среды по образцам слюны и шерсти. Однако в недавних исследованиях на собаках оба эти метода оказались недостаточно чувствительными и специфичными (20-22), поэтому их использование, по крайней мере в настоящее время, не рекомендуется.
Заключение
Диагноз «атопический дерматит» может быть установлен только на основании данных анамнеза и клинического обследования и после исключения других дифференциальных диагнозов. Диагностика атопического дерматита собак посредством только лабораторных тестов невозможна, поэтому во избежание ошибочной диагностики их чрезмерного использования следует избегать. Выявление аллергена, ставшего причиной заболевания, является завершающим этапом процесса обследования и существенно влияет на долгосрочное ведение и качество жизни пациента.
-
1.Hillier A, Griffin CE. The ACVD task force on canine atopic dermatitis (I): incidence and prevalence. Vet Immunol Immunopathol 2001;81:147-151.
-
2.Nuttall TJ, Marsella R, Rosenbaum MR, et al. Update on pathogenesis, diagnosis, and treatment of atopic dermatitis in dogs. J Am Vet Med Assoc 2019;254:1291-1300.
-
3.Hill PB, Moriello KA, DeBoer DJ. Concentrations of total serum IgE, IgA, and IgG in atopic and parasitized dogs. Vet Immunol Immunopathol 1995;44:105-113.
-
4.Rostaher A, Dolf G, Fischer NM, et al. Atopic dermatitis in a cohort of West Highland White Terriers in Switzerland. Part II: estimates of early life factors and heritability. Vet Dermatol 2020;31:276-e266.
-
5.Favrot C, Steffan J, Seewald W, et al. A prospective study on the clinical features of chronic canine atopic dermatitis and its diagnosis. Vet Dermatol 2010;21:23-31.
-
6.Hensel P, Santoro D, Favrot C, et al. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Vet Res 2015;11:196.
-
7.Park S, Ohya F, Yamashita K, et al. Comparison of response to immunotherapy by intradermal skin test and antigen-specific IgE in canine atopy. J Vet Med Sci 2000;62:983-988.
-
8.Ansotegui IJ, Melioli G, Canonica GW, et al. IgE allergy diagnostics and other relevant tests in allergy, a World Allergy Organization position paper. World Allergy Organ J 2020;13:100080.
-
9.Marsella R. Hypersensitivity disorders. In: Miller HW, Griffin CE, Campbell KL, eds. Muller & Kirk’s Small Animal Dermatology. 7th ed. St. Louis Missouri: Elsevier Mosby, 2013;363-431.
-
10.Hillier A, DeBoer DJ. The ACVD task force on canine atopic dermatitis (XVII): intradermal testing. Vet Immunol Immunopathol 2001;81:289-304.
-
11.Stedman K, Lee K, Hunter S, et al. Measurement of canine IgE using the alpha chain of the human high affinity IgE receptor. Vet Immunol Immunopathol 2001;78:349-355.
-
12.Gedon NKY, Boehm T, Klinger CJ, et al. Agreement of serum allergen test results with unblocked and blocked IgE against cross-reactive carbohydrate determinants (CCD) and intradermal test results in atopic dogs. Vet Dermatol 2019;30:195-e161.
-
13.Piccione ML, DeBoer DJ. Serum IgE against cross-reactive carbohydrate determinants (CCD) in healthy and atopic dogs. Vet Dermatol 2019;30:507-e153.
-
14.Mohammaddavoodi A, Panakova L, Christian M, et al. Prevalance of immunoglobulin E against cross-reactive carbohydrate determinants (CCD) and impact of a blocker in seasonal allergy tests. Tierarztl Prax Ausg K Kleintiere Heimtiere 2020;48:404-409.
-
15.Bousquet J, Heinzerling L, Bachert C, et al. Practical guide to skin prick tests in allergy to aeroallergens. Allergy 2012;67:18-24.
-
16.Ballauf B. Vergleich von Intrakutan- und Pricktest in der Allergiediagnostik beim Hund. Tierärztl Prax 1991;19:428-430.
-
17.Carnett MJH, Plant JD. Percutaneous prick test irritant threshold concentrations for eight allergens in healthy nonsedated dogs in the USA. Vet Dermatol 2018;29:117-e147.
-
18.Carmona-Gil AM, Sanchez J, Maldonado-Estrada J. Evaluation of skin prick-test Reactions for allergic sensitization in dogs with clinical symptoms compatible with atopic dermatitis; a pilot study. Front Vet Sci 2019;6;448.
-
19.Rostaher A, Mueller R, Meile L, et al. Venom immunotherapy for hymenoptera allergy in a Dog. Vet Dermatol 2021;32(2):206-e52.
-
20.Coyner K, Schick A. Hair and saliva test fails to identify allergies in dogs. J Small Anim Pract 2019;60:121-125.
-
21.Lam ATH, Johnson LN, Heinze CR. Assessment of the clinical accuracy of serum and saliva assays for identification of adverse food reaction in dogs without clinical signs of disease. J Am Vet Med Assoc 2019;255:812-816.
-
22.Vovk LU, Watson A, Dodds WJ, et al. Testing for food-specific antibodies in saliva and blood of food allergic and healthy dogs Vet J 2019;249:89-89.




 1093
1093  15 мин
15 мин



.png)








