Введение
Животные с отитом часто поступают в ветеринарные клиники первичного звена, и у собак отит чаще всего бывает вызван аллергией. Развившееся в слуховом проходе воспаление может привести к вторичному разрастанию бактерий или дрожжевых грибов и, если его не лечить, — к хроническому отиту. В таких случаях в игру вступают способствующие факторы, например средний отит, кальцификация слухового прохода или приводящие к появлению более вирулентных штаммов бактерий изменения микробной флоры (1).
В некоторых случаях, особенно при участии отдельных возбудителей, таких как Pseudomonas spp., может наблюдаться образование биопленки (1). Биопленка — сложная живая биомасса со специфичной структурой, которая сильно затрудняет ее уничтожение. Микроорганизмы внутри биопленки используют ряд факторов для повышения своей устойчивости к действию как иммунной системы, так и антибиотиков (2). В этой статье мы попытаемся прояснить концепцию биопленок, снабдив читателя знаниями, необходимыми для их распознавания, и тем самым облегчая реализацию соответствующих стратегий лечения.
Биопленки — сложные структуры, образующиеся в результате скопления микроорганизмов, создающих бактериальный агрегат с уникальным составом. Биопленка состоит преимущественно из воды (90%), а остальные 10% составляют микробную биомассу (2). Помимо воды, основные компоненты матрицы биопленки — внеклеточные полисахариды (extracellular polysaccharides, EPS), ДНК и белки. Такое сочетание компонентов придает биопленке особенные свойства, существенно влияющие на выживание и персистирование составляющих ее бактерий (3).
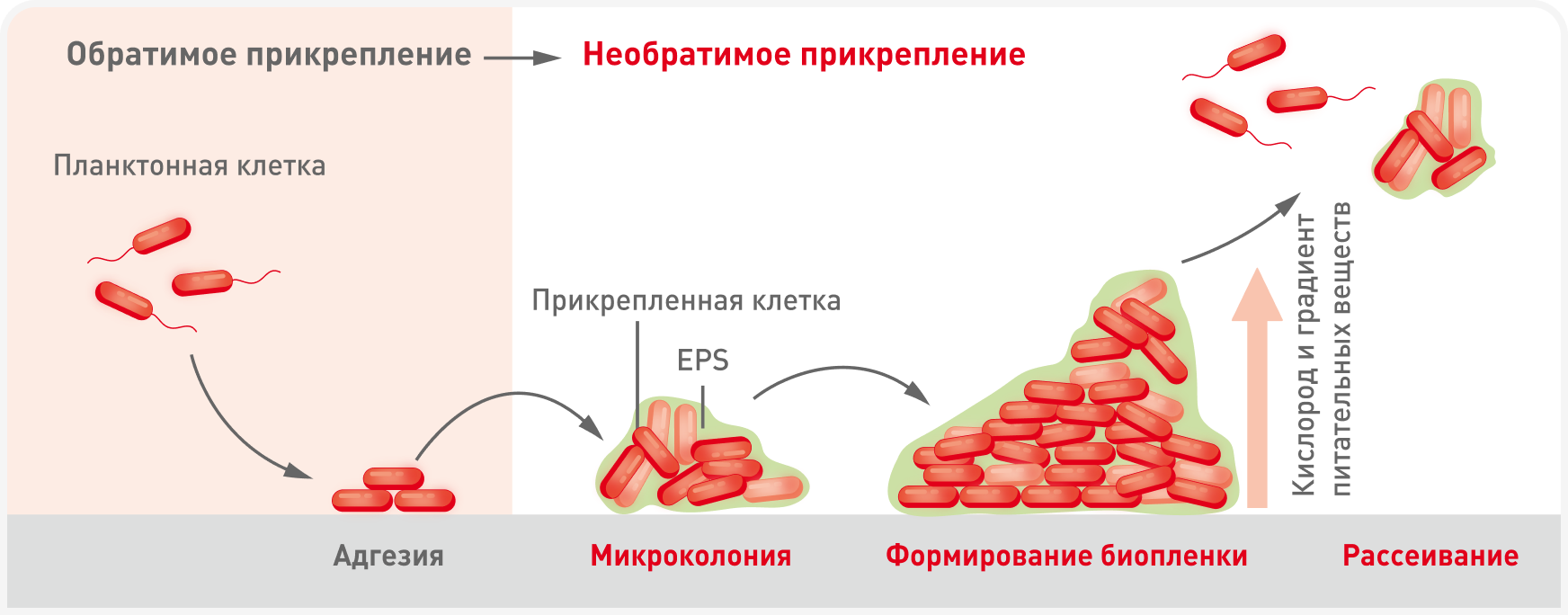
Трехмерная структура биопленки образуется в несколько этапов. Процесс начинается с прикрепления, или адгезии, свободно живущих, так называемых планктонных бактерий к поверхности ткани. Это прикрепление становится необратимым, затем бактерии переходят в оседлое состояние. Впоследствии они агрегируются, образуя микроколонию, и активируют определенные гены, запускающие выработку внеклеточного матрикса. Как только биопленка созревает, фрагменты, содержащие планктонные бактерии, отделяются и рассеиваются в окружающей среде, способствуя распространению биопленки (2). Образование биопленки обеспечивает ей важное преимущество — возможность формировать градиент питательных веществ, уровня кислорода, скорости роста, генетических свойств от внешних к внутренним слоям (4) (Рисунок 1).
Одна из ключевых характеристик бактериальных биопленок — способность создавать устойчивый к антибиотикам защитный барьер. Бактерии в составе биопленки лучше защищены от воздействия противомикробных препаратов, что затрудняет лечение связанных с биопленкой инфекций (5). Кроме того, биопленки более устойчивы к стрессорным факторам окружающей среды, в том числе к атаке иммунной системы хозяина; например, они могут быть устойчивы к фагоцитозу лейкоцитами (6). Другая важная характеристика биопленок — способность к горизонтальному переносу генов. Благодаря непосредственной близости бактериальных клеток внутри биопленки между ними может происходить более эффективный обмен генетической информацией, способствующий распространению полезных для популяции бактерий признаков или устойчивости к антибиотикам (7).
Важную роль в сложном процессе формирования биопленки играет способность бактерий обнаруживать плотность популяции клеток и реагировать на нее регуляцией экспрессии генов (по-английски называемая quorum sensing). Важно, что quorum sensing позволяет бактериям координировать поведение в зависимости от плотности их расположения, синхронизируя внутри биопленки выработку ключевых компонентов внеклеточного матрикса, таких как EPS (2).
Образовывать биопленки способны и грамположительные, и грамотрицательные бактерии. Из бактерий, часто наблюдаемых при ушных инфекциях у собак, особенно часто к образованию биопленки приводит Pseudomonas spp. (8). Биопленки могут состоять из микроорганизмов одного или нескольких видов; последнее явление называют полимикробной биопленкой. Такое разнообразие в составе биопленок подчеркивает сложность этих структур и их роль при различных инфекциях (9).
Исследования в медицине человека выявили, что биопленки образуют Staphylococcus epidermidis, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Streptococcus viridans, Staphylococcus aureus и Enterococcus faecalis (2). В ветеринарнии обнаружены бактерии, образующие биопленку другой, помимо ушной, локализации, в том числе Staphylococcus spp. и E. coli (10). Биопленки образуют не только бактерии, но и грибы, такие как Malassezia spp. (11). Это подчеркивает более широкое значение образования биопленок различными видами микроорганизмов и акцентирует внимание на важности понимания концепции биопленок и умения бороться с ними в различных клинических и ветеринарных контекстах. Это также подчеркивает, что при работе с биопленками важно не сосредотачиваться исключительно на Pseudomonas spp., а исследовать возможное присутствие других микроорганизмов; для оптимизации эффективного лечения этих инфекций возбудителя необходимо идентифицировать. Биопленки могут представлять собой сложные сообщества из различных видов микроорганизмов, поэтому крайне важно подходить к решению возникающих разнообразных проблем тщательно и многосторонне и точно определять вызвавших их возбудителей.
Объем образования бактериальной биопленки часто классифицируют по шкале от слабой до сильной, в зависимости от выявленных штаммов бактерий или грибов (12); например, в исследовании было показано, что Pseudomonas aeruginosa образует биопленку активнее других видов микроорганизмов (13). Эта классификация уровней образования биопленок может пригодиться для оценки потенциальной вирулентности и устойчивости к лечению различных штаммов бактерий, помогая в принятии клинических решений и выборе подходов к терапии, но ее реальное клиническое и терапевтическое воздействие еще предстоит изучить (12).
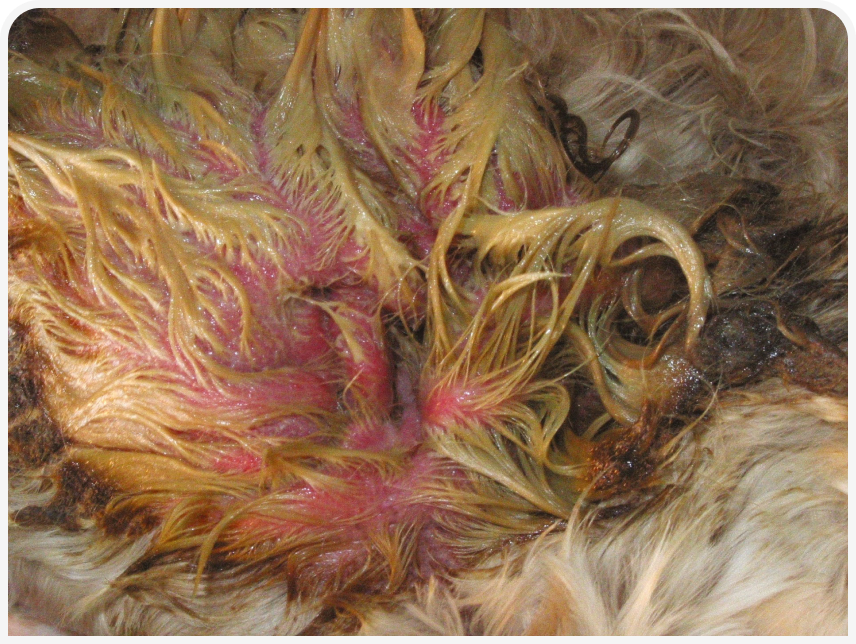
Обнаружить биопленку может быть сложно, поскольку эти структуры часто нелегко увидеть невооруженным глазом и требуются специальные методы их обнаружения (14). В клинической практике макроскопический вид биопленок может различаться в зависимости от их зрелости, типа включенных микроорганизмов и пораженной области тела (Рисунки 2 и 3). Их описывают по следующим характеристикам (14):
• Цвет: от белого/прозрачного до серого/зеленого
Клинически инфекция Pseudomonas spp. проявляется классической сероватой/зеленоватой, липкой или склизкой биопленкой. Это может быть связано с присутствием альгината и выработкой пиоцианина (15).
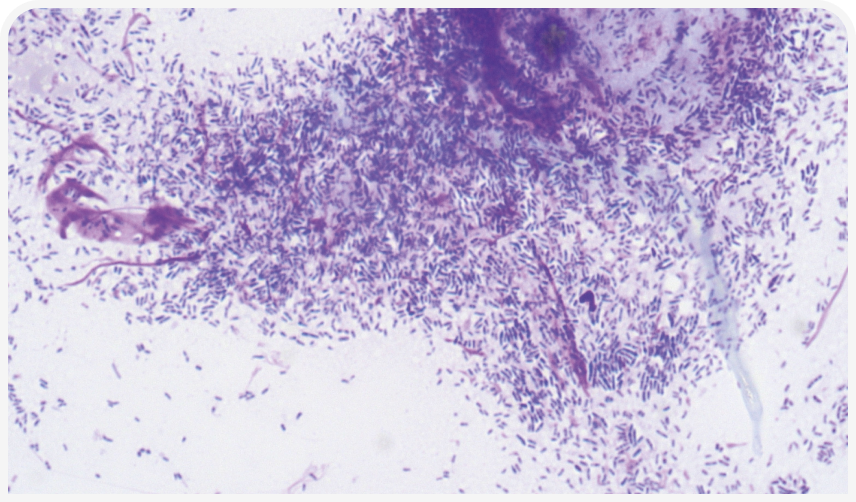
Цитологический вид биопленок зависит от разрастающихся микроорганизмов и метода подготовки образца. Можно использовать специальные методы окраски, например периодическую кислотную реакцию Шиффа, которая обнаруживает полисахаридную матрицу, но в широкой клинической практике они, как правило, недоступны, что затрудняет идентификацию биопленки (16). Однако важно отметить, что биопленки могут выглядеть как скопления клеток (бактерий, спор, грибковых гиф), окруженных внеклеточным матриксом (который не всегда виден) и полиморфноядерными нейтрофилами или мононуклеарными клетками (17) (Рисунок 4).
Один из диагностических критериев идентификации биопленки — посев на бактерии или грибы, способные образовывать биопленку. Однако считать его золотым стандартом не следует, поскольку возможны ложноотрицательные результаты посева и выявлены расхождения результатов бактериального посева и профилирования ампликона 16S (18). Традиционные методы культивирования в основном поддерживают рост планктонных бактерий и не могут точно имитировать условия биопленки. Следовательно, антибиотикограммы от планктонных бактерий могут не отражать истинный профиль чувствительности к противомикробным препаратам и принимаемые по ним решения о терапии окажутся неверными. Более того, из‑за потенциальных различий степени зрелости биопленки между отобранными образцами и культивируемыми бактериями воспроизвести на планктонных культурах условия образования биопленки может оказаться сложно. Бактерии внутри биопленок значительно более устойчивы к антибиотикам по сравнению с их планктонными аналогами, поэтому оценка чувствительности к антибиотикам хуже применима для прогнозирования эффективности лечения (15).
Это ограничение подчеркивает необходимость применять альтернативные методы оценки образования биопленки на основе показаний оптической плотности, такие как анализ биопленки с окрашиванием кристаллическим фиолетовым и использованием бульонной среды (например, бульона Лурии–Бертани, бульона Мюллера–Хинтона или трипсиново‑соевого бульона). Эти методы позволяют полнее оценить наличие бактериальной биопленки и ее потенциальное влияние на результаты лечения антибиотиками (8), но обычно для рутинного бактериального посева их не используют. Другие методы, также обычно не используемые для рутинной диагностики (19):
• Сканирующая электронная микроскопия
Учитывая трудности непосредственной визуализации биопленок, для их точной и всесторонней идентификации часто требуется сочетание нескольких методов.
Как было упомянуто ранее, биопленки значительно повышают устойчивость бактерий к антибиотикам, часто в 100–1000 раз по сравнению с планктонными бактериями (5). Следовательно, необходимо разработать стратегические методы разрушения биопленок, тем самым позволяя проводить эффективное лечение антибиотиками и противогрибковыми препаратами. Инновационные решения для уменьшения образования биопленок не только повышают эффективность антибиотиков, но и открывают значительные перспективы в решении проблем устойчивости бактерий к антибиотикам, что подчеркивает критическую важность исследований и разработок в ветеринарной медицине. Поэтому целесообразно провести обзор ряда методов лечения, обычно используемых в качестве дополнительных и показавших эффективность против биопленок.
NAC (N-ацетилцистеин) — муколитическое средство, обладающее также антимикробными свойствами. Хотя точные механизмы его действия на биопленки изучены лишь частично, показано, что эта молекула растворяет биопленки. В частности, она ингибирует адгезию бактерий, уменьшает выработку внеклеточного полисахаридного матрикса и способствует разрушению зрелых биопленок, разрывая дисульфидные связи внутри внеклеточного матрикса. Это повышает проницаемость и восприимчивость биопленки к противомикробному лечению (20). Кроме того, ее способность разрушать биопленки продемонстрирована in vitro на штаммах бактерий Staphylococcus pseudintermedius и Pseudomonas aeruginosa из слухового прохода. Эффективность зависит от концентрации NAC; рекомендуется концентрация около 1–2% (13). Важно отметить, что безопасность NAC при интратимпанальной инъекции доказана в экспериментальных условиях, поэтому можно предполагать, что препарат нетоксичен для уха и пригоден для лечения хронических выделений из уха (21).
Трис-ЭДТА (этилендиаминтетрауксусная кислота-трометамин) оказывает антимикробное действие по хорошо изученному механизму. ЭДТА обладает хелатирующим действием, связывая двухвалентные катионы, что приводит к разрушению наружной клеточной мембраны грамотрицательных бактерий. Разрушение мембраны приводит к высвобождению липополисахаридов и повышает проницаемость бактериальных клеток к воздействию других противомикробных средств.
Трис-компонент, обладающий буферными свойствами, усиливает хелатирующие свойства ЭДТА (22). Трис-ЭДТА оказывает разрушающее действие на биопленку из P. aeruginosa, но на биопленки из Staphylococcus spp. часто действует иначе, подавляя их рост, но не разрушая их (13). Стоит отметить, что при совместном применении с некоторыми противомикробными препаратами Трис-ЭДТА может снижать эффективность их антибактериального действия, и для уточнения этих взаимодействий необходимы дальнейшие исследования. Однако в сочетании с другими противомикробными препаратами Трис-ЭДТА эффективен и оказывает синергетическое воздействие на биопленку. В исследованиях in vitro было показано, что Трис-ЭДТА может снижать минимальные бактерицидные концентрации (minimum bactericidal concentrations — MBC) и минимальные подавляющие концентрации (minimum inhibitory concentrations — MIC) таких антибиотиков, как марбофлоксацин и гентамицин, тем самым повышая их эффективность, особенно в отношении P. aeruginosa с множественной лекарственной устойчивостью (22).
Кроме Трис-ЭДТА, против биопленок активны несколько других соединений. Это, например, наночастицы серебра, повидон-йод, мед (23, 24). В продолжающихся исследованиях биопленок выявляют также новые соединения. Возможно, в отношении биопленок эффективны низкотемпературная атмосферная микроволновая плазма, ингибиторы quorum sensing, бактериофаги (23, 25). Эти методы могут повысить эффективность борьбы с биопленками и позволяют надеяться на появление в будущем более эффективных стратегий лечения.
Образование биопленки при ряде бактериальных инфекций, включая Pseudomonas spp. и Staphylococcus spp., становится важным фактором вирулентности, особенно при хроническом отите. Крайне важно учитывать также роль в образовании биопленки дрожжей, таких как Malassezia spp. Неэффективность лечения, характеризующаяся специфичными макроскопическими и микроскопическими особенностями, в основном обусловлена образованием биопленки. Обнаружив или заподозрив биопленку, можно разработать более адекватные терапевтические стратегии и увеличить вероятность искоренить этот стойкий вариант инфекции.
Скрытая часть айсберга: разгадка тайны биопленок
Изучение формирования биопленки: какие в ней участвуют микроорганизмы?
Эксперт-квиз по диагностике зудаМетоды обнаружения и визуализации биопленок
• Текстура: склизкая, липкая или слизистая
• Форма: плоская или объемная (трехмерная).

• Трансмиссионная (просвечивающая) электронная микроскопия
• Конфокальная лазерная сканирующая микроскопия
• Флуоресцентная гибридизация in situ
• Молекулярно-биологические методы, например полимеразная цепная реакция (ПЦР), позволяют обнаружить определенные гены, связанные с образованием биопленки.
Эффективные стратегии разрушения биопленок

Заключение
-
1.Paterson S. Discovering the causes of otitis externa. In Pract. 2016;38(S2):7-11. DOI:10.1136/inp.i470
-
2.Sharma S, Mohler J, Mahajan SD, et al. Microbial biofilm: a review on formation, infection, antibiotic resistance, control measures, and innovative treatment. Microorganisms 2023;11(6):1614. DOI:10.3390/microorganisms11061614
-
3.Mann EE, Wozniak DJ. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol. Rev. 2012;36(4):893-916. DOI:10.1111/j.1574-6976.2011.00322.x
-
4.Stewart PS, Franklin MJ. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 2008;6(3):199-210. DOI:10.1038/nrmicro1838
-
5.Høiby N, Bjarnsholt T, Givskov M, et al. Antibiotic resistance of bacterial biofilms. Int. J. Antimicrob. Agents 2010;35(4):322-332. DOI:10.1016/j.ijantimicag.2009.12.011
-
6.Ciofu O, Moser C, Jensen PØ, et al. Tolerance and resistance of microbial biofilms. Nat. Rev. Microbiol. 2022;20(10):621-635. DOI:10.1038/s41579-022-00682-4
-
7.Jolivet-Gougeon A, Bonnaure-Mallet M. Biofilms as a mechanism of bacterial resistance. Drug Discov. Today Technol. 2014;11:49-56. DOI: 10.1016/j.ddtec.2014.02.003
-
8.Robinson VH, Paterson S, Bennett C, et aI. Biofilm production of Pseudomonas spp. isolates from canine otitis in three different enrichment broths. Vet. Dermatol. 2019;30(3):218-e67. DOI:10.1111/vde.12738
-
9.Orazi G, O’Toole GA. “It Takes a Village”: Mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms. J. Bacteriol. 2019;202(1):10.1128/jb.00530-19. DOI:10.1128/jb.00530-19
-
10.Abdullahi UF, Igwenagu E, Mu’azu A, et al. Intrigues of biofilm: A perspective in veterinary medicine. Vet. World 2016;9(1):12-18. DOI:10.14202/vetworld.2016.12-18
-
11.Brilhante RSN, Rocha MG da, Guedes GM de M, et al. Malassezia pachydermatis from animals: Planktonic and biofilm antifungal susceptibility and its virulence arsenal. Vet. Microbiol. 2018;220:47-52. DOI:10.1016/j.vetmic.2018.05.003
-
12.Monfredini PM, Souza ACR, Cavalheiro RP, et al. Clinical impact of Candida spp. biofilm production in a cohort of patients with candidemia. Med. Mycol. 2018;56(7):803-808. DOI:10.1093/mmy/myx133
-
13.Chan WY, Hickey EE, Page SW, et al. Biofilm production by pathogens associated with canine otitis externa, and the antibiofilm activity of ionophores and antimicrobial adjuvants. J. Vet. Pharm. Ther. 2019; 42(6):682-692. DOI:10.1111/jvp.12811
-
14.Aparna MS, Yadav S. Biofilms: microbes and disease. Braz. J. Infect. Dis. 2008;12:526-530. DOI:10.1590/S1413-86702008000600016
-
15.Høiby N, Bjarnsholt T, Moser C, et al. ESCMID guidelines for the diagnosis and treatment of biofilm infections 2014. Clin. Microbiol. Infect. 2015;21:S1-S25. DOI:10.1016/j.cmi.2014.10.024
-
16.Parnell-Turner H, Griffin CE, Rosenkrantz WS, et al. Evaluation of the use of paired modified Wright’s and periodic acid Schiff stains to identify microbial aggregates on cytological smears of dogs with microbial otitis externa and suspected biofilm. Vet. Dermatol. 2021;32(5):448-e122. DOI:10.1111/vde.13009
-
17.Gelardi M, Giancaspro R, Cassano M. Biofilm in sino-nasal infectious diseases: the role nasal cytology in the diagnostic work-up and therapeutic implications. Eur. Arch. Otorhinolaryngol. 2023;280(4):1523-1528. DOI:10.1007/s00405-022-07748-2
-
18.Léonard C, Thiry D, Taminiau B, et al. External ear canal evaluation in dogs with chronic suppurative otitis externa: comparison of direct cytology, bacterial culture and 16S amplicon profiling. Vet. Sci. 2022;9(7):366. DOI:10.3390/vetsci9070366
-
19.Kishen A, Haapasalo M. Biofilm models and methods of biofilm assessment. Endodontic Topics 2010;22(1):58-78.
-
20.Dinicola S, De Grazia S, Carlomagno G, et al. N-acetylcysteine as powerful molecule to destroy bacterial biofilms. A systematic review. Eur. Rev. Med. Pharmacol. Sci. 2014;18(19):2942-2948.
-
21.Chan CY, Conley SF, Salameh S, et al. Otologic safety of intratympanic N-acetylcysteine in an animal model. Int. J. Pediatr. Otorhinolaryngol. 2023;173:111702. DOI:10.1016/j.ijporl.2023.111702
-
22.Buckley LM, McEwan NA, Nuttall T. Tris-EDTA significantly enhances antibiotic efficacy against multidrug-resistant Pseudomonas aeruginosa in vitro. Vet. Dermatol. 2013;24(5):519-e122. DOI:10.1111/vde.12071
-
23.Sadekuzzaman M, Yang S, Mizan M, et al. Current and recent advanced strategies for combating biofilms. Compr. Rev. Food Sci. Food Saf. 2015;14(4):491-509. DOI:10.1111/1541-4337.12144
-
24.Hoekstra MJ, Westgate SJ, Mueller S. Povidone-iodine ointment demonstrates in-vitro efficacy against biofilm formation. Int. Wound J. 2017;14(1):172-179. DOI:10.1111/iwj.12578
-
25.Kim EJ, Hyun JE, Kang YH, et al. In-vitro antibacterial and antibiofilm effects of cold atmospheric microwave plasma against Pseudomonas aeruginosa causing canine skin and ear infections. Vet. Dermatol. 2022;33(1):29-e10. DOI:10.1111/vde.13030




 648
648  7 мин
7 мин



.png)








