Введение
Трансплантация фекальной микробиоты (FMT) — метод переноса кишечного микробиома от здорового донора больному реципиенту с целью улучшения микробиома и уменьшения тяжести заболевания. Впервые этот метод был описан в китайском учебнике по неотложной медицине в 320 году н. э. Однако вплоть до начала этого столетия он использовался редко, пока не были накоплены обширные знания о микробиоме кишечника и дисбиозе.
У человека FMT сейчас чаще всего проводят по поводу заболеваний желудочно-кишечного тракта (ЖКТ), но в исследованиях было изучено использование этого метода по другим показаниям, включая заболевания печени, метаболический синдром, лечение антибиотико-резистентных инфекций, психические расстройства, ожирение (1, 2).
У животных доказано благоприятное действие FMT при парвовирусном энтерите у щенков (3), также этот метод представляется перспективным при хронической диарее у собак (4, 5), но о применении его у кошек на сегодняшний день имеется описание только одного клинического случая (6). В настоящее время научно обоснованных рекомендаций или какого-либо консенсуса по скринингу доноров, дозировке или наилучшему протоколу для животных нет, но недавно сформированная группа международных экспертов, Консорциум банка фекалий животных-компаньонов, работает над такими рекомендациями, и предварительные результаты должны быть представлены в этом году.
Несмотря на отсутствие консенсуса, FMT считают довольно безопасным методом лечения собак с острыми или хроническими нарушениями работы желудочно-кишечного тракта, который во многих случаях позволяет снизить тяжесть заболевания. В этой статье будут рассмотрены различные отчеты об использовании FMT у собак с поражениями желудочно-кишечного тракта, представлено описание процедуры и обсуждены несколько клинических наблюдений.
Как упоминалось выше, благоприятный эффект FMT был продемонстрирован в различных исследованиях. В одном рандомизированном контролируемом исследовании изучали лечение парвовирусного энтерита у щенков (66 животных) в двух ветеринарных клиниках либо только «стандартными» методами, либо стандартным лечением плюс FMT (3).
MT позволила значимо сократить периоды госпитализации и время до выздоровления (с медианой 3 дня против 6 дней в контрольной группе) и увеличить выживаемость (26 из 33, 79%) по сравнению с контрольной группой (21 из 33, 64%), но разница не была статистически значимой. В другом исследовании однократное введение фекальной микробиоты при первичном осмотре 18 собакам с острой диареей позволило на 7-й день улучшить оценку фекалий в той же степени, что и лечение метронидазолом, а на 28-й день наблюдалось значимое улучшение консистенции фекалий по сравнению с группой, получавшей метронидазол (7).
Кроме того, FMT способствовала восстановлению микробиома кишечника в первой группе до здорового уровня на 28-й день, тогда как у собак, получавших метронидазол, в этот период сохранялся дисбактериоз, значимо выраженный по сравнению как с собаками, получавшими FMT, так и со здоровыми собаками. Однако в небольшом плацебо-контролируемом пилотном исследовании у 8 собак с острой геморрагической диареей FMT не имела клинического эффекта по сравнению с контрольной группой, получавшей фиктивное лечение (8).
Относительно успешного лечения собак с хронической диареей и/или хронической энтеропатией методом FMT опубликованы один отчет о клиническом наблюдении и одна серия клинических наблюдений, а также две аннотации научных исследований (4, 5, 9, 10). В серию наблюдений были включены 9 собак с рефрактерным воспалительным заболеванием кишечника (ВЗК), не отвечавшим на лечение пробной диетой, антибиотиками, кортикостероидами, циклоспорином (4).
После FMT у всех собак наблюдалось значимое снижение индекса активности воспалительных заболеваний кишечника у собак (CIBDAI (11) — Блок 1)) и увеличение количества Fusobacterium spp. У 7 из 9 собак концентрация Fusobacterium в фекалиях была ниже по сравнению с собаками-донорами до FMT. У собак Fusobacterium — основной продуцент короткоцепочечных жирных кислот (КЦЖК) и важный компонент здорового кишечного микробиома, а при хронических энтеропатиях у собак очень часто встречаются дисбактериоз и снижение уровня кишечных микробов, продуцирующих КЦЖК (Блок 2) (12).
Дисбактериоз также был выявлен в исследовании у 16 собак с хронической диареей, каждой из которых назначали по одному сеансу FMT, со значимым улучшением индекса дисбиоза фекалий* через неделю после лечения (10). Ретроспективное исследование, лежащее в основе других аннотаций (5, 9), подробнее обсудим в следующем разделе.
Информация об использовании FMT у кошек очень ограниченная (Рисунок 1); в настоящее время есть описание одного клинического случая, в котором был положительный ответ на FMT у кошки с рефрактерным язвенным колитом (6).
Эффективность FMT при хронической энтеропатии (ХЭ) была продемонстрирована в следующем исследовании. В нем был проведен ретроспективный обзор данных в когорте из 36 собак (возрастом от 0,6 до 13 лет, медиана 6,3) с ХЭ, получавших FMT в качестве дополнительной терапии в клинике автора в период 2019–2021 годов (5).
У всех собак реакция на стандартное научно обоснованное лечение отсутствовала или была слабой, и для включения в исследование требовался период наблюдения не менее трех месяцев после FMT. Критериями исключения были (i) увеличение дозы какой-либо текущей поддерживающей терапии в течение рассматриваемого периода (ii) кишечные паразиты или (iii) начало нового иммуносупрессивного лечения или диеты параллельно с FMT. FMT вводили по стандартизированному протоколу всем собакам, используя двух разных собак-доноров c индексом дисбиоза* ниже -2 (нормобиоз) (12).
Все 36 собак при включении в исследование получали лечение ХЭ в течение 1–110 месяцев (медиана 21), при этом основными жалобами были рефрактерная диарея (28 из 36), вялость (15 из 36) и различные побочные эффекты лекарственных препаратов (10 из 36). При включении в исследование 34 из 36 собак получали лечение кортикостероидами, 20 из 36 получали иммуносупрессивные препараты второй линии, включая микофенолат, хлорамбуцил, циклоспорин или азатиоприн. Корм у 26 из 36 собак был гидролизованным, у 8 из 36 — на основе монобелка, а у 2 — легкоусвояемой «кишечной» диетой.
34 собаки получили от 2 до 5 сеансов FMT, причем большинство (26 собак) получили 3 сеанса. Остальные 2 собаки получили по одному сеансу FMT, и у них не было отмечено ответа на лечение. После лечения клиническое улучшение по шкале CIBDAI было отмечено у 75% собак (27 из 36), чаще всего в виде повышения уровня активности (20 из 36), улучшения балльной оценки фекалий (19 из 36) и увеличения веса и/или улучшения аппетита (10 из 36).
В последней группе ранее отмечался плохой аппетит и/или субнормальные показатели кондиции тела. Поддерживающую дозу кортикостероидов у 6 собак удалось уменьшить до уровня ниже, чем до FMT. Одной собаке, у которой ранее развивались частые обострения диареи, купируемые только тилозином, антибиотики не требовались в течение 21 месяца после третьего сеанса FMT (случай №2 в следующем разделе), а у другой собаки, ранее получавшей лечение метронидазолом и иммуномодулирующими препаратами, после FMT удалось прекратить прием метронидазола.
При включении оценка по шкале CIBDAI составляла 2–17 баллов (медиана 6), и в течение первого месяца после последнего сеанса FMT этот показатель значимо снизился до 1–9 баллов (медиана 2). Образцы фекалий для анализа индекса дисбиоза* (норма ≤ 0) при включении в исследование были получены от 23 собак. У собак, не отвечавших на FMT, на момент включения результат был значимо выше, чем у тех, кто хорошо отреагировал на лечение.
Ранее было показано, что высокий индекс дисбиоза коррелирует со снижением микробного разнообразия и меньшим количеством бактериальных таксонов (у человека низкое микробное разнообразие до FMT прогностически неблагоприятно для ответа на FMT (13)). Побочные эффекты были умеренными и необычными; у 6 из 36 собак (3 ответивших и 3 не ответивших) в течение 48 часов после FMT развилась диарея, причем у двух из этих собак в течение 24 часов после FMT также появились боли в животе или прямой кишке. Однако все побочные эффекты были самоограничивающимися.
Это исследование, однако, имеет несколько ограничений. Исследование было ретроспективным, динамику микробиома и метаболома не отслеживали, а также в нем не было контрольной группы. Тем не менее его результаты свидетельствуют о возможности использования FMT в качестве дополнительной терапии ХЭ у собак, плохо отвечающих на лечение.
Как упоминалось ранее, в настоящее время консенсуса или научно обоснованного руководства по скринингу доноров или наилучшего протокола проведения FMT нет (14). Приводимые ниже рекомендации основаны на личном клиническом опыте автора и недавних исследованиях (5, 7).
Животное-донор должно быть клинически здоровым, с нормальной балльной оценкой упитанности и оценкой 0–3 балла по шкале CIBDAI (т. е. отсутствие клинических признаков хронического заболевания желудочно-кишечного тракта) (11); по сути, требуется найти донора с большим количеством полезных микробов и без потенциальных фекальных возбудителей.
Кроме того, животное не должно получать сырую пищу, длительную лекарственную терапию и антибиотики в течение по крайней мере 6 месяцев, предпочтительно дольше. У кошек для донорства предпочтительны животные, не имеющие доступа на улицу, чтобы избежать заражения паразитами от мелких грызунов и т. д.
У всех потенциальных доноров необходимо исключить кишечные паразитозы, включая Giardia intestinalis. Чтобы обеспечить высокий уровень полезных микроорганизмов, таких как бактерии, продуцирующие короткоцепочечные жирные кислоты (КЦЖК), и Clostridium hiranonis, потенциальным донорам проводят скрининг на индекс дисбиоза* собак или кошек (12). В клинике автора собак-доноров также тестируют на отсутствие Salmonella spp., Campylobacter jejuni, Clostridioides difficile и энтеротоксиногена Clostridium perfringens, включая netF-токсин Clostridium perfringens.
Однако такой обширный скрининг доноров не всегда обязателен — поскольку у человека для успешного лечения язвенного колита оказались крайне важны микробный состав и разнообразие донорского трансплантата, наиболее важным у животных может оказаться исключение кишечных паразитов и обеспечение высокого содержания полезных микробоорганизмов (13).
Кроме того, в этом исследовании у реципиентов с хорошим ответом на FMT были выявлены более высокое разнообразие микробной флоры фекалий до и после FMT, а также более высокие уровни КЦЖК и вторичных желчных кислот в фекалиях после FMT по сравнению с собаками, не реагировавшими на лечение.
Для FMT у собак можно использовать весьма различное количество фекалий (14). В настоящее время автор использует 5 г донорских фекалий на кг массы тела реципиента для собак до 30 кг и кошек; 2–3 г фекалий на кг массы тела для собак весом более 30 кг. Это относительно большое количество, но оно ассоциируется с благоприятным исходом у большинства собак с ХЭ (5). Реципиент не должен принимать пищу в течение 6 часов до FMT, но разрешается пить воду.
Непосредственно перед процедурой реципиента выводят на прогулку на 30–40 минут для осуществления дефекации. За 15 минут до вмешательства можно ввести низкую дозу ацепромазина (0,1 мг/кг массы тела), если нет противопоказаний; хотя некоторые ветеринарные врачи пропускают этот шаг, если реципиент спокоен, премедикация обычно помогает собаке расслабиться и отдохнуть после процедуры, что позволяет трансплантату дольше контактировать со слизистой толстой кишки. По опыту автора, кошкам перед FMT необходима полная седация.
Фекальный трансплантат можно вводить через верхние или нижние отделы желудочно-кишечного тракта. У человека при наличии показаний к лечению желудочно-кишечного тракта (рецидивирующая инфекция Clostridioides difficile, язвенный колит, болезнь Крона) исход при обоих путях введения одинаков (15–17), но в опубликованных сообщениях о проведении FMT у собак чаще использовали ректальный путь введения с помощью удерживающей клизмы или колоноскопии.
Можно использовать свежие или замороженные фекалии; в последнем случае их сначала размораживают на ночь в холодильнике. (У человека при рецидивирующей или рефрактерной инфекции Clostridioides difficile эффективность FMT с использованием замороженных фекалий и свежего материала одинакова (18)).
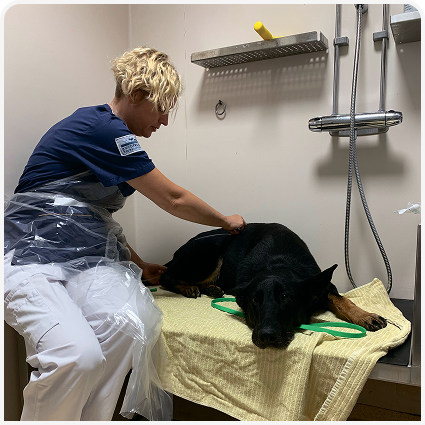
Фекалии смешивают со стерильным физиологическим раствором (20–120 мл) до получения желаемой консистенции, а затем процеживают через сито. Фильтрат отсасывают в стерильный шприц (или несколько шприцев) объемом 60 мл и либо оставляют при комнатной температуре, либо нагревают до температуры тела на водяной бане перед использованием, поскольку ощущение от большого объема холодного (непосредственно из холодильника) вводимого материала у реципиента будет крайне неприятным. Трансплантат вводят ректально через катетер калибра 12–16 французских единиц (Fr) (7).
Катетер перед введением обильно смазывают, его окончание должно располагаться примерно на уровне последнего ребра (Рисунок 2). FMT проводят собаке в положении стоя, в стернальной или латеральной позиции (Рисунок 3).
Далее следует минимизировать у собаки физические нагрузки в течение 4–6 часов, чтобы увеличить время контакта трансплантированных фекалий со слизистой кишечника. Кормить собаку в этот период также не следует, поскольку присутствие пищи в желудке стимулирует сокращения толстой кишки.
В клинике автора принят стандартный протокол (Блок 3), согласно которому собакам с ХЭ проводят серии из трех FMT с интервалом в 10–20 дней, поскольку опыт показал, что один сеанс лечения часто не позволяет уменьшить клинические проявления или его действие недостаточно продолжительное. Однако, если положительного эффекта после двух сеансов не отмечено, третий сеанс FMT не проводят (5).
Альма (Рисунок 4) — стерилизованная сука золотистого ретривера, у которой в трехлетнем возрасте развилась стероидозависимая ХЭ. В возрасте 5 лет она получала поддерживающую дозу метилпреднизолона внутрь (0,4 мг/кг в сутки) и гидролизованную диету на основе изолята соевого белка.
Это позволяло в некоторой степени купировать клинические признаки ХЭ, но сохранялись вялость, боли в животе, периодическая рвота, диарея, субнормальная балльная оценка упитанности (BCS) на 3,5 из 9 баллов (на 15% ниже оптимальной BCS), легкая и среднетяжелая атрофия мышц. Было предпринято несколько попыток уменьшить дозу метилпреднизолона, но с каждой попыткой клинические проявления ухудшались.
В качестве дополнительного иммунодепрессанта был назначен микофенолат, но это не позволило снизить дозу метилпреднизолона. Владелец согласился попробовать FMT в качестве дополнительной терапии, и собаке были проведены три отдельных сеанса FMT в виде ректальных удерживающих клизм с интервалами 10–14 дней. У Альмы развился очень положительный и быстрый клинический ответ; она стала значительно более активной и контактной, больше играла с другими собаками и прибавила в весе 2 кг, что позволило постепенно снизить дозу метилпреднизолона до 0,2 мг/кг через день.
В анализе фекалий Альмы исходный индекс дисбиоза* составил 1,2 (нормобиоз), но с заметными изменениями липидного профиля фекалий, в том числе стеринов и жирных кислот, при этом концентрация фекального копростанола превышала норму для собак в 24 раза. Холестерин в просвете кишечника метаболизируется кишечными микроорганизмами до копростанола, и это соединение плохо всасывается в кишечнике (19), то есть у Альмы было повышенное преобразование холестерина в копростанол.
Через две недели после первой FMT липидный профиль фекалий нормализовался, что коррелировало с нормализацией BCS. Положительные эффекты FMT сохранялись 7 месяцев, но затем Альма снова стала вялой и похудела; однако эти клинические проявления удалось купировать второй серией FMT и временным увеличением дозы метилпреднизолона.
Молтас — интактный кобель немецкой овчарки, всю жизнь страдавший хронической, частично рефрактерной диареей. Он также страдает атопическим дерматитом, рецидивирующей пиодермией и хроническим отитом. В возрасте 1,5 лет его клиническое состояние на фоне ежедневного приема высоких доз преднизолона было довольно стабильным, но BCS составляла 3 балла из 9, и уменьшение дозы преднизолона привело к ухудшению клинических проявлений.
Азатиоприн оказался неэффективен, как и многочисленные пробные диеты, включая легкоусвояемую диету и две разные диеты на основе одного вида белка. Наиболее тяжелые обострения диареи купировались тилозином или метронидазолом, и в этот период Молтаса направили к автору. Ему назначили гидролизованную диету на основе нового белка и циклоспорин, что имело некоторый эффект и позволило немного снизить дозу преднизолона.
В возрасте 2,5 лет циклоспорин был заменен хлорамбуцилом, что привело к клиническому улучшению и увеличению массы тела до нормальной BCS. Во время лечения хлорамбуцилом преднизолон удалось заменить на будесонид, вызывающий меньше побочных эффектов, по 3 мг через день. Молтасу также проводили аллергенспецифическую иммунотерапию, лечебные ванны с хлоргексидином два раза в неделю, по 4 мг метилпреднизолона через день в качестве поддерживающей терапии по поводу кожного заболевания.
В течение следующих 2,5 лет состояние Молтаса было относительно стабильным, но каждые несколько месяцев диарея обострялась. Незначительные обострения удавалось контролировать временным увеличением дозы будесонида (по 3 мг ежедневно в течение 3–10 дней). Более тяжелые обострения развивались примерно каждые шесть месяцев и не купировались иммуносупрессивной терапией, поэтому Молтасу назначили тилозин (по 25 мг/кг каждые 24 часа в течение 7 дней).
В возрасте 5 лет симптомы со стороны желудочно-кишечного тракта усилились, так что ежемесячно возникали обострения диареи, регургитация и вялость. Эта повышенная активность заболевания привела к усилению полипрагмазии с более частым применением тилозина с будесонидом (3 мг через день), метилпреднизолоном (4 мг через день), хлорамбуцилом (3 мг через день) и кобаламином (1 мг внутрь один раз в неделю). Во время осмотра при пальпации была выявлена выраженная боль в животе. В биохимическом анализе сыворотки крови отмечались умеренная гипоальбуминемия (28 г/л; норма 30–45 г/л) и слабое-умеренное снижение уровня общего белка (51 г/л; норма 61–75 г/л).
Во время предыдущего обследования шесть месяцев назад эти параметры находились в пределах нормы. Несмотря на еженедельную поддерживающую терапию, концентрация кобаламина в сыворотке крови также значимо снизилась до 221 пмоль/л (норма 180–708 пмоль/л). Кишечных паразитов в образцах фекалий обраужено не было.
Молтасу были назначены 1 мг кобаламина через день и три курса FMT в ректальных удерживающих клизмах с интервалом в 14 дней. После первой FMT эпизоды регургитации прекратились, а после второй улучшилась консистенция фекалий, Молтас стал активнее и больше играл (Рисунок 5).
После третьего сеанса FMT диарея прекратилась и пальпация живота стала безболезненной. Кроме того, сывороточные концентрации альбумина и общего белка повысились и вернулись к норме. В течение следующего 21 месяца состояние Молтаса было значительно стабильнее, хотя каждый третий месяц у него наблюдались эпизоды диареи, которые длились 1–2 дня и купировались самостоятельно.
Через 21 месяц консистенция фекалий постепенно ухудшилась, и произошло тяжелое обострение. Увеличение дозы кортикостероидов имело лишь ограниченный эффект, и Молтасу возобновили лечение тилозином в течение недели, после чего провели вторую серию из трех сеансов FMT с положительным эффектом, аналогично первому курсу.
Гарольд — интактный кобель французского бульдога (Рисунок 6), который будучи щенком и молодой собакой перенес стойкую инфекцию Giardia intestinalis. Инфекция в итоге была вылечена, но диарея, мелена и потеря веса сохранялись. Местный ветеринарный врач лечил Гарольда метронидазолом и кортикостероидами, что привело лишь к незначительному улучшению, а в годовалом возрасте провел биопсию тонкой и толстой кишок на всю толщину. Гистопатологический диагноз: гранулематозный колит и умеренный лимфоцитарно-плазмоцитарный энтерит с умеренным расширением млечного сосуда (лимфатический сосуд брыжейки тонкой кишки). К лечению был добавлен сульфасалазин, что не имело эффекта, поэтому в возрасте 1,5 лет Гарольда направили в гастроэнтерологическое отделение в клинике автора.
В этот период он был слегка вялым; BCS составляла 3 из 9 баллов. Был начат 6-недельный курс терапии гранулематозного колита энрофлоксацином, что привело к быстрому купированию клинических проявлений и повышению массы тела. При осмотре сразу после окончания лечения симптомы у Гарольда отсутствовали, а BCS составляла 4 из 9 баллов. Однако через 3 недели диарея (преимущественно по типу колита) и рвота рецидивировали.
Поскольку при проведении биопсии биоптаты из толстой кишки не были отправлены на посев и исследование бактериальной чувствительности, было неизвестно, был ли Гарольд до начала лечения энрофлоксацином инфицирован E. coli с множественной лекарственной устойчивостью. Так как резистентность к фторхинолонам развивается быстро, было весьма вероятно, что в его кишечном микробиоме закрепилась E. coli с множественной лекарственной устойчивостью (20).
У боксеров с гранулематозным колитом было показано, что резистентность E. coli к фторхинолонам сопровождается недостаточной эффективностью лечения энрофлоксацином, устойчивостью к хлорамфениколу, рифампицину и триметоприм-сульфаниламиду (20), а множественная лекарственная устойчивость и неэффективность лечения часто приводят к эвтаназии больных собак. Альтернативным антибиотиком у собак с гранулематозным колитом и инфекцией E. coli, резистентной к фторхинолонам (21), считают карбапенем, но этот класс антибиотиков критически важен в медицине человека и поэтому во многих странах запрещен для ветеринарного применения.
В этот период владелец согласился попробовать FMT. После первого вмешательства 2–3 дня сохранялись метеоризм, фекалии с резким запахом и легкая рвота, и, хотя качество фекалий затем немного улучшилось, через 14 дней диарея повторилась. Второй сеанс FMT через 16 дней после первого снова сопровождался аналогичными признаками в течение 2–3 дней, но последующее улучшение качества фекалий было более выраженным.
В этот период Гарольду также давали пробиотик с несколькими штаммами микроорганизмов. После третьего сеанса FMT побочных эффектов не развилось, стул был нормальным, и Гарольд был значительно активнее и контактнее. Был продолжен прием мультиштаммового пробиотика через день наряду с диетой с гидролизованным белком, и при последнем осмотре (через 14 месяцев после FMT 3) полная ремиссия сохранялась.
Ина — интактная сука немецкой овчарки, у которой с годовалого возраста проявлялись признаки ХЭ, хотя их удавалось купировать при помощи диеты на основе гидролизованного белка в сочетании с мультиштаммовым пробиотиком. В возрасте 2 лет у нее развилась инфекция мочевыводящих путей, которую лечили в местной ветеринарной клинике (неизвестными) антибиотиками.
После приема антибиотиков у Ины развились выраженное вздутие живота, вялость и гипорексия; эти клинические признаки были аналогичны развившимся у нее во время первоначального обследования по поводу ХЭ. Был заподозрен дисбактериоз кишечника, вызванный лечением антибиотиками, в анализе образца фекалий был выявлен индекс дисбиоза* 6,2 (Рисунок 7), что соответствует тяжелому дисбактериозу. Через шесть недель после окончания.
Трансплантация фекальной микробиоты (FMT) — перспективный метод гастроэнтерологического лечения домашних животных, причем количество нежелательных побочных эффектов в опубликованных исследованиях очень небольшое. В настоящее время подходы ветеринарных врачей к дозировке и протоколам проведения FMT у мелких животных несколько различаются, и консенсус в отношении рекомендаций по лечению еще не достигнут. FMT можно использовать при разных патологиях, включая щенков с парвовирусной инфекцией, и, по-видимому, во многих случаях у собак с хроническими энтеропатиями, плохо реагирующими на лечение. Терапия с помощью FMT в отдельных случаях также позволяет снизить частоту использования антибиотиков. FMT при заболеваниях желудочно-кишечного тракта



FMT при плохо реагирующих хронических энтеропатиях
Порядок проведения FMT
Скрининг доноров

Дозирование и порядок проведения FMT
.png)
.png)
Случай №1 — Альма
.png)
Случай №2 — Молтас
.png)
Случай №3 — Гарольд
.png)
Случай №4 — Ина
.png)
Заключение


телефона ниже для сброса пароля.



на номер
+7 {{ formatted_phone }}


Вы успешно прошли тест!
{{ formatted_phone }}.
Введите последние четыре цифры номера входящего звонка.

весь модуль
всех видеоуроков модуля














 1047
1047  15 мин
15 мин







