Ветеринарным врачам общей практики часто приходится наблюдать молодых кошек по поводу диареи. Врачи обычно включают в дифференциальный диагноз диареи паразитарные заболевания кишечника, и таких пациентов часто эмпирически лечат противопаразитарными препаратами, не проводя дообследования. Во многих случаях такой подход эффективен, поскольку обеспечивает относительно быстрое улучшение состояния и купирование симптомов. Хотя инфекция родом Giardia и различными гельминтами обычно полностью купируется этими препаратами, менее часто диагностируемую Tritrichomonas foetus, простейшее, по внешнему виду аналогичное роду Giardia, при таком эмпирическом лечении полностью устранить невозможно. Этот паразит может стать причиной фрустрации у владельцев кошек и ветеринарных врачей, поскольку симптомы вначале могут отвечать на терапию стандартными противопаразитарными препаратами, но после прекращения лечения быстро рецидивировать. Кроме того, без специальной диагностики этих простейших иногда сложно выявить. Поэтому вполне вероятно, что повышение уровня информированности об этом возбудителе позволит быстрее его выявлять и эффективнее элиминировать у молодых кошек с отсутствием явной реакции на лечение или при рецидиве диареи.
Введение
Заболеваемость, распространенность и предрасположенность
Tritrichomonas foetus (T. foetus) распространена по всему миру, с расчетным показателем распространенности 10-59% (1). Данных о географической распространенности сравнительно мало; однако в одном популяционном исследовании кошек в Великобритании рассчитали, что носителями этого простейшего могут быть примерно 20% здоровых кошек, а в отдельном исследовании распространенности T. foetus в образцах кала при диарее, поступивших в лаборатории Великобритании, паразита выявляли в 14,4% образцов (2). С другой стороны, в исследовании группы кошек в США, участвующих в выставках, распространенность инфекции T. foetus оказалась выше и составила 31% (3). Распространенность T. foetus наиболее высока у чистопородных кошек и у кошек, содержащихся в группах. Было показано, что вероятность носительства повышается по мере повышения количества животных на квадратный метр площади в местах их содержания – таким образом, скученность, по-видимому, является одним из важных факторов риска. Аналогичным образом, повышенный риск инфицирования выявлен при использовании общих туалетных лотков и при вылизывании животными друг друга (2,3). Вызываемая T. foetus диарея обычно наблюдается у молодых кошек (в среднем в возрасте до 8 месяцев), причем более 75% случаев поражения происходят в возрасте менее одного года. Однако риск носительства сохраняется для кошек любого возраста, и в части случаев могут развиваться клинические признаки заболевания (1,4).е:
Этиология и патогенез
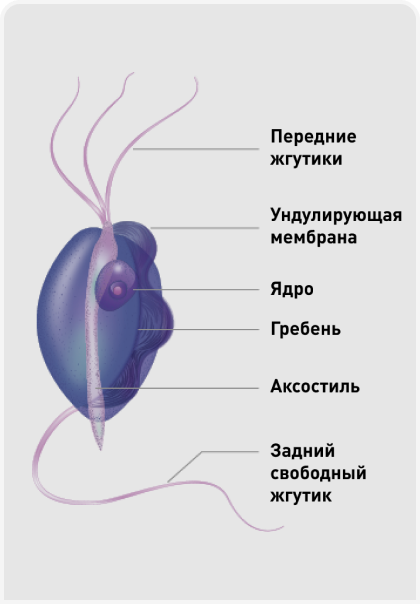
T. foetus представляет собой жгутиковое простейшее, существующее только в форме трофозоита. Таким образом, оно не формирует цист (в отличие от лямблий) и размножается путем простого деления надвое. Визуально микроорганизмы имеют длину примерно 10-26 мкм и ширину примерно 3-5 мкм, и их форму часто называют «грушевидной» или «веретенообразной». Каждый микроорганизм имеет три передних жгутика (по сравнению с родом Pentatrichomonas, имеющим пять жгутиков), обеспечивающих этому простейшему подвижность (Рисунок 1) (1,5). У кошек T. foetus паразитирует в основном в желудочно-кишечном тракте, локализуясь преимущественно в толстой кишке и, в меньшей степени, в дистальной части подвздошной кишки (6). Инвазия вызывает воспаление слизистой, проявляющееся лимфоплазмоцитарным или нейтрофильным колитом (7). Другие неоднократно описанные клинические признаки – раздражение анальной области и возможное недержание кала. При инвазии в толстой кишке простейшие находятся в непосредственной близости от поверхности слизистой кишечника и часто связываются с эпителиальными клетками и криптами слизистой толстой кишки. При контакте с кишечной стенкой микроорганизмы связываются в ней путем специфичного лиганд-рецепторного взаимодействия, причем это связывание конкурентное и насыщаемое.
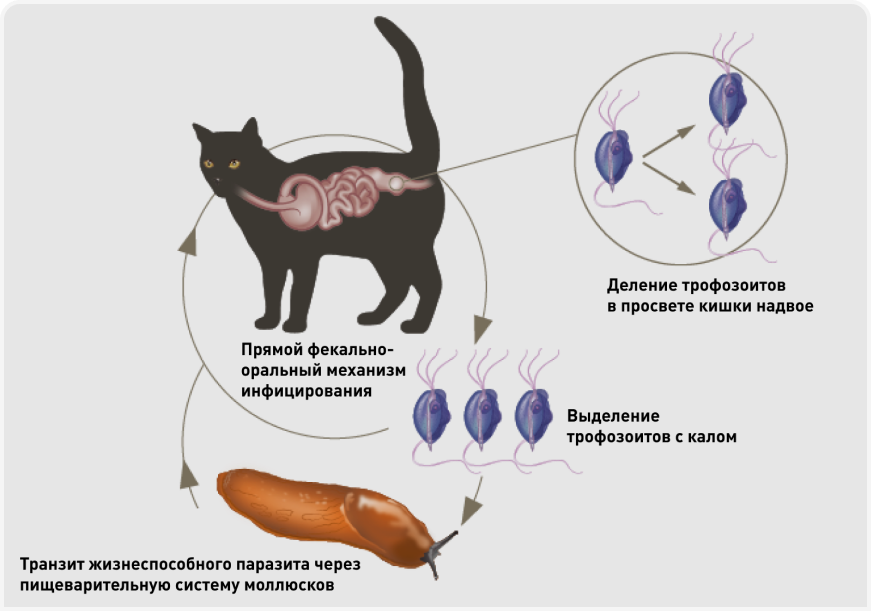
Микроорганизм связывается с различными молекулами на поверхности клеток, включая лектины сиаловой кислоты, липофосфогликаны, цистеиновые протеазы, белки адгезии. После связывания микроорганизмы становятся способны разрушать молекулы иммуноглобулинов и лактоферринов, тем самым уклоняясь от действия иммунной системы (8). Паразит передается почти исключительно фекально-оральным путем. Трофозоиты выделяются с фекалиями инфицированных кошек и в этой форме при попадании в организм другой кошки могут вызывать инфицирование. В настоящее время точно неизвестно, имеются ли у этого паразита промежуточные хозяева, однако показано, что трофозоиты T. foetus могут сохранять жизнеспособность при проглатывании и транзите через кишечник наземных брюхоногих моллюсков, таких как слизни, и при последующем проглатывании восприимчивой кошкой сохраняют инфекционность (Рисунок 2) (9). В окружающей среде трофозоиты могут выживать несколько дней, если остаются во влажных каловых массах, однако в сухих и аэробных условиях высыхают и погибают (10).
Клинические проявления
Поражаются кошки любого возраста, породы и пола. Обычно заболевание клинически проявляется хронической толстокишечной диареей с периодическими обострениями и ремиссиями. Диарея часто полуоформленная («коровьей лепешкой»), но иногда водянистая, и в некоторых случаях может содержать свежую кровь и/или слизь. Нередко развивается тенезм, у некоторых животных периодически имеет место частичное недержание кала. Кал во многих случаях также может иметь выраженный неприятный запах. Вследствие диареи и обусловленного ею регулярного вылизывания (Рисунок 3) часто развиваются выраженные эритема и отек промежности и заднего прохода, болезненные для кошки; реже воспаление и тенезм приводят к выпадению прямой кишки (1,5). Других клинических проявлений, помимо диареи и воспаления в области промежности, в большинстве случаев не выявляют. В ряде случаев описана некоторая задержка в росте, и у отдельных пациентов отмечают снижение массы тела относительно нормы. Также описаны общие неспецифические проявления, такие как ухудшение состояния шерстного покрова, но специфичных клинических симптомов не описано (1,5).

Диагностика
Подозрение на инфекцию Tritrichomonas foetus должно возникать при выявлении соответствующих этому заболеванию данных анамнеза и клинических проявлений. Перечень дифференциальных диагнозов представлен в Таблице 1, и для дифференциации T. foetus от указанных патологий требуется провести тщательное клиническое обследование. Данные стандартных исследований крови в случае T. foetus обычно неспецифичны, и часто все параметры остаются в пределах нормы. Однако, поскольку риск инфекции T. foetus повышен в основном для молодых пациентов, при выявлении отклонений в анализе крови у молодых животных важно не допустить гипердиагностики (например, при выявлении повышения уровней щелочной фосфатазы и фосфата). Некоторые изменения могут также быть вторичными на фоне хронических клинических проявлений заболевания. Наиболее часто в таких случаях выявляют изменения уровней электролитов, особенно гипокалиемию, гипонатриемию и гипохлоремию, в результате продолжающейся диареи. Как правило, они легкие и субклинические, однако при более тяжелом течении болезни могут произойти и более глубокие изменения (1,5). Хотя при анализе крови невозможно выявить какие-либо специфичные для инфекции T. foetus изменения, это исследование остается ценной частью диагностического обследования, поскольку позволяет исключить дифференциальные диагнозы, выявить сопутствующие заболевания и оценить электролитные изменения, которые необходимо купировать в рамках плана лечения. Как и при анализе крови, при использовании методов визуальной диагностики у кошек с инфекцией T. foetus выявляют сравнительно немного специфичных данных (5). При тяжелом течении с развитием выраженного колита при УЗИ органов брюшной полости можно выявить признаки утолщения слизистой кишечника (локального или диффузного), хотя отсутствие таких данных не исключает диагноза паразитарной инвазии. При выявлении утолщения кишечной стенки ее слои обычно остаются сохранными; в противном случае следует в большей степени подозревать не инфекцию T. foetus, а поражение инфильтративной опухолью.Как и при анализе крови, в таких случаях имеются веские основания использовать один из методов визуальной диагностики. Отсутствие других клинических данных косвенно свидетельствует в пользу диагноза инфекции T. foetus, и «визуализация» оказывается ценным методом исследования для дифференциальной диагностики.

Окончательный диагноз
Окончательный диагноз инфекции T. foetus можно установить либо при прямой визуализации микроорганизма, либо при исследовании кала методом полимеразной цепной реакции (ПЦР). Перед приготовлением мазка или проведением ПЦР для увеличения числа микроорганизмов также можно провести культивирование кала, увеличив таким образом чувствительность этих методов. Прямую визуализацию проводят с помощью световой микроскопии мазка кала. Этот метод исследования относительно простой; требуются только световой микроскоп и мазки, и его считают идеальным методом первого ряда для выявления T. foetus. Поэтому его следует применять во всех случаях первичного выявления у кошек толстокишечной диареи. При анализе мазка кала важно, что при световой микроскопии микроорганизмы родов Giardia и Pentatrichomonas hominis могут быть очень сходны с T. foetus, и поэтому затем следует провести точное определение всех визуализированных видов паразитов (3,11).
Это правило важно главным образом для принятия решений по лечению, поскольку простейшие P. hominis непатогенны и лечения не требуют (1), в то время как лямблиоз, как правило, реагирует на лечение значительно лучше, чем T. foetus, и обычно его можно купировать обычными противопаразитарными препаратами (например, фенбендазолом), в отличие от инфекции T. foetus. Мазки можно получить из образцов нескольких типов. Проще всего получить образцы из самопроизвольно выделенного кала; однако если пациент отказывается испражняться в условиях клиники, образцы кала можно успешно получить альтернативными методами. Важно отметить, что исследование образцов нормального кала (в отсутствие диареи) редко позволяет получить положительные результаты, поэтому проводить исследование таких образцов не рекомендуется (1).
Опытным путем установлено, что адекватными методами получения образцов служат извлечение кала из просвета толстой кишки ректальной петлей и промывание толстой кишки (1). Промывание кишечника проводят аналогично промыванию (лаважу) трахеи, обеспечив седацию кошки и вливая в прямую и ободочную кишки жидкость. После инстилляции жидкости для облегчения ее перемешивания можно осторожно пропальпировать толстую кишку через брюшную стенку, и только затем извлекать жидкость. Это позволяет получать образцы двух типов: первый – взвесь, каплю которой можно поместить на предметное стекло и получить влажный препарат для прямой световой микроскопии; второй – более крупный образец для центрифугирования, позволяющий сформировать гранулу для последующего исследования методом ПЦР.
Мазок кала для микроскопии получают по методике приготовления влажного препарата. Из промывных образцов содержимого толстой кишки берут каплю, которую можно сразу же поместить на предметное стекло и высушить на воздухе. Образцы из выделенных при диарее каловых масс или полученные ректальной петлей сначала следует взвесить в стерильном физиологическом растворе, и только затем продолжать процедуру получения образца. После высыхания образец можно фиксировать и непосредственно в процедурной окрасить по Романовскому, чтобы облегчить визуализацию паразитов. После закрытия покровным стеклом образец затем можно просматривать под световым микроскопом при 20-40-кратном увеличении. Чтобы облегчить выявление паразитов, можно опустить конденсор ниже.
Образцы кала для мазка необходимо исследовать свежими (в течение шести часов после получения) (10), поэтому перевозить их во внешнюю лабораторию неоптимально. После шести часов диагностическая чувствительность выявления T. foetus в мазках кала начинает снижаться, поэтому исследование рекомендуется проводить в процедурной сразу же после приготовления мазка (12). Метод исследования мазка кала очень прост, недорог и обеспечивает очень высокую специфичность диагностики (то есть явное выявление паразита означает, что он с высокой вероятностью присутствует); однако чувствительность этого метода невысока. При количественном исследовании для определения этого показателя обнаружили, что чувствительность однократного исследования мазка кала может составлять лишь 14%, и поэтому настоятельно рекомендуется, чтобы повысить вероятность выявления микроорганизма, оценивать несколько мазков из нескольких образцов (3). Чувствительность может дополнительно снижаться при присутствии в образце загрязнителей, таких как гигиенический наполнитель для лотков, и поэтому в случаях направления образцов во внешние лаборатории важно до отправления отделить такие загрязнители от образца (12). Также чувствительность тестирования уменьшается при антимикробном лечении (например, метронидазолом), и уменьшить влияние такого лечения можно, отменив по крайней мере за несколько дней до исследования все виды антибактериальной терапии (1).

«
Повышение уровня информированности о возбудителе Tritrichomonas foetus позволит быстрее его выявлять и эффективнее элиминировать у молодых кошек с отсутствием явной реакции на лечение или при рецидиве диареи
Альтернативным методом диагностики инфекции T. foetus в кале считают ПЦР. Это исследование можно провести в качестве исследования первого ряда, но оно дороже и занимает больше времени, чем визуальный анализ мазка кала, и поэтому часто его назначают после получения отрицательного результата микроскопии мазка. Ввиду низкой чувствительности микроскопии мазка кала во всех случаях подозрения на инфекцию T. foetus, не идентифицированным при микроскопии, показано проведение ПЦР кала. Этот метод также можно использовать для подтверждения диагноза по данным микроскопии мазка, если точность идентификации паразита вызывает сомнение.
Метод ПЦР основан на обнаружении какого-либо из целого ряда высококонсервативных регионов генома T. foetus; чаще всего используют праймеры для генов ITS1 и ITS2 (13). Метод ПЦР позволяет обнаруживать живых и мертвых паразитов, и для их обнаружения оказалось достаточно иметь в образце 10 микроорганизмов (14). Чувствительность метода ПЦР не описана, однако предполагается, что она может быть значительно выше, чем у микроскопии мазка кала. Также она может изменяться в зависимости от плотности микроорганизмов в образце, причем увеличение количества отдельных паразитов приводит к повышению чувствительности. Важная особенность метода ПЦР – высокая специфичность для выявления возбудителей рода Tritrichomonas. Это означает, что при носительстве Giardia или Pentatrichomonas у кошки диагноз по данным микроскопии мазка может быть неверно истолкован как инфекция T. foetus, но при ПЦР эти другие паразиты не будут обнаружены, кроме случаев сочетанной инфекции ими и T. Foetus (11). Таким образом, ПЦР служит ценным подтверждающим методом после идентификации паразита при микроскопии мазка, и поэтому во всех случаях настоятельно рекомендуется наряду с микроскопией мазка кала проводить ПЦР (15).
Образцы для ПЦР можно получать аналогично используемым для получения мазка кала. Опять же, рекомендуется объединить несколько образцов за несколько дней, и для увеличения чувствительности исследования анализировать их совместно, поскольку описано непостоянное выделение паразита в кале (7). Образцы материала диареи можно направлять в свежем виде, либо центрифугировать образцы промывания толстой кишки, получать гранулы и направлять для анализа уже их. Хотя чувствительность ПЦР выше, чем микроскопии мазка кала, из-за небольшого числа микроорганизмов в образцах этот метод также может приводить к ложноотрицательным результатам. Чтобы повысить его чувствительность, требуется большее количество организмов, и одним из решений может быть культивирование микроорганизма перед исследованием.
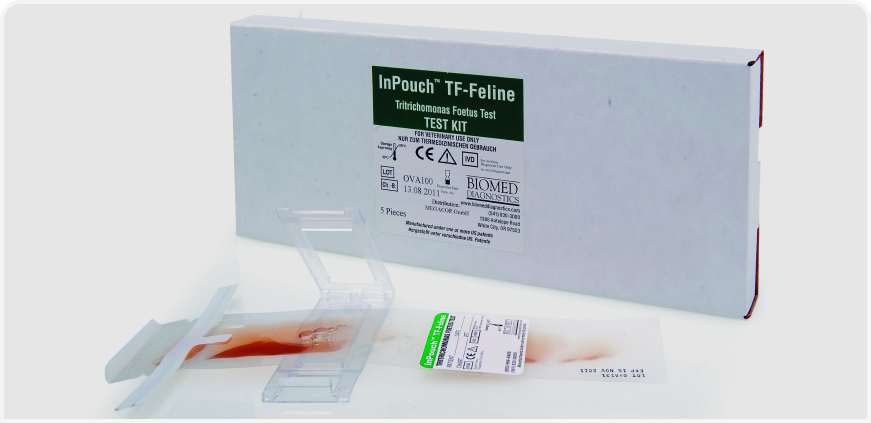
Выпускается коммерческий набор (Рисунок 4) для культивирования T. foetus в образцах кала.1 Этот набор представляет собой закрытый блок, в который требуется внести очень небольшую гранулу кала (размером примерно с рисовое зернышко). Культивировать образцы требуется около 72 часов при температуре 37°C, и до 12 дней при комнатной температуре (16). Недостатком этого метода является заметное увеличение общего времени диагностики, однако ему также свойствен ряд преимуществ. Во-первых, увеличение количества микроорганизмов увеличивает чувствительность микроскопии и ПЦР мазка кала. Во-вторых, набор также содержит ряд ингибиторов роста, подавляющих одновременный рост родов Giardia и Pentatrichomonas. Эти ингибиторы предотвращают рост обоих паразитов, поэтому все обнаруженные в мазке кала простейшие после культивирования с очень высокой вероятностью окажутся T. foetus, а не другими сходными паразитами (16). С учетом вышеупомянутой информации, «золотым стандартом» исследования на Tritrichomonas foetus следует считать культивирование кала с последующей прямой микроскопией мазка и ПЦР образца кала. 1InPouch TF (Biomed Diagnostics, Уайт-сити, штат Орегон, США).
Лечение
Процесс лечения и элиминирования T. foetus может оказаться сложным и разочаровывающим. Начального клинического эффекта часто удается достичь после курса терапии метронидазолом, но этот препарат не позволяет элиминировать инфекцию, поэтому, несмотря на первоначальное клиническое улучшение, после отмены препарата диарея рецидивирует (12). Фактически лечение метронидазолом увеличивает общую продолжительность сохранения клинических проявлений заболевания, поэтому при подтвержденном диагнозе не рекомендуется (1). Аналогично, пробное лечение метронидазолом считают неприемлемым для дифференцирования инфекции Giardia (которая иногда может купироваться терапией метронидазолом) и инфекции T. foetus (которая никогда не элиминируется метронидазолом). К сожалению, T. foetus относительно устойчивы к обычным противомикробным и противопаразитарным препаратам. В настоящее время эффективным для элиминирования инфекции считают только один препарат. Это препарат из семейства нитроимидазолов, ронидазол (ronidazole) (17). На момент написания статьи ронидазол не лицензирован и не одобрен иным образом для использования у кошек ни в одной из стран мира, но доступен в некоторых ветеринарных аптеках с рецептурно-производственным отделом для использования не по утвержденным показаниям в отсутствие эффективных лицензированных методов лечения. Эта форма препарата относительно дорогая, но рекомендуется благодаря надежности обеспечиваемых аптеками с рецептурно-производственным отделом дозы и состава. Если этот вид лечения недоступен, или если расходы признаны чрезмерными, препарат также можно приобрести в форме порошка, в которой его используют для лечения паразитарных заболеваний у голубей.
Эту лекарственную форму не рекомендуют для использования в качестве препарата первого ряда из-за неизвестного качества и потенциально неодинакового состава, но в отдельных наблюдениях она оказалась эффективна для элиминации инфекции у кошек. В литературе описана схема дозирования ронидазола по 30 мг/кг каждые 24 часа внутрь в течение 14 дней (18). Препарат хорошо переносится многими кошками, однако описан ряд побочных эффектов. Как правило, по характеру они аналогичны наблюдаемым для высоких доз метронидазола, и большинство из них связаны с проявлением нейротоксичности. Чаще всего наблюдают такие побочные эффекты, как вялость, снижение аппетита, атаксия и, если препарат не отменить, судороги (19). Большинство побочных эффектов быстро разрешаются после отмены препарата, но, если лечение после выявления побочных эффектов не прекращено, может потребоваться активная поддерживающая терапия (1). Побочные эффекты наблюдаются значительно чаще, чем при лечении метронидазолом, и считаются связанными со сравнительно более длительным периодом полувыведения ронидазола по сравнению с метронидазолом.Если после лечения диарея рецидивирует, в принципе, целесообразно повторить курс лечения, особенно при заметном улучшении состояния на фоне приема препарата и последующем резком ухудшении после завершения курса терапии. Однако если после начального курса лечения отмечен период хорошего самочувствия, а ухудшение произошло через несколько недель или месяцев, целесообразно подтвердить инфекцию T. foetus, поскольку клинические проявления могут быть вызваны другим заболеванием. Наряду с лечением ронидазолом, имеются ограниченные данные и об эффективности других стратегий лечения. Автору неизвестны какие-либо публикации относительно диетологических рекомендаций при этом заболевании, но можно руководствоваться общими правилами ведения энтеропатий: любые изменения в диету следует вносить только на основании взвешенного решения, поскольку иногда они могут приводить к толстокишечной диарее, особенно при использовании низкокачественных или несбалансированных кормов. Дополнительная противомикробная терапия не показана. Доказательных данных в пользу или против применения БАД и пробиотиков нет, поэтому рекомендации в их отношении дать невозможно.
Прогноз
Лечение ронидазолом обычно приводит к относительно быстрому улучшению консистенции и качества стула уже в первые 14 дней лечения. Однако в более тяжелых случаях для улучшения может потребоваться несколько больше времени; считают, что этот срок коррелирует с активностью воспаления в кишечнике и обусловлен более высокой паразитарной нагрузкой (1). У кошек, не получавших лечения инфекции T. foetus, диарея в конечном итоге разрешается самостоятельно примерно в 88% случаев, но для разрешения может потребоваться до двух лет (20). У 55% кошек после самостоятельного разрешения диареи инфицирование сохраняется, и потому они могут продолжать выделять трофозоиты и представлять опасность заражения для других кошек. Поэтому применять эту стратегию ведения пациентов не рекомендуется.
Заключение
Толстокишечная диарея у молодых кошек, наблюдаемых в общеклинической ветеринарной практике, встречается относительно часто. При таких клинических проявлениях в круг дифференциальной диагностики важно включать Tritrichomonas foetus, причем оценить вероятность этого диагноза уже на начальных этапах диагностического поиска. Золотым стандартом обследования считают культивирование кала с последующими микроскопией и ПЦР мазка кала. Лечение следует начинать после установления диагноза, и в настоящее время единственным эффективным препаратом считают ронидазол.
Литература
- Gookin JL. Trichomoniasis. In: Greene CE, ed. Infectious diseases of the dog and cat. 4th Ed. St Louis: Saunders 2012;797-801.
- Gunn-Moore DA, McCann TM, Reed N, et al. Prevalence of Tritrichomonas foetus infection in cats with diarrhea in the UK. J Feline Med Surg 2007;9:214-218.
- Gookin JL, Stebbins ME, Hunt E, et al. Prevalence of and risk factors for feline Tritrichomonas foetus and Giardia infection. J Clin Microbiol 2004;42:2707-2710.
- Gookin JL, Breitschwerdt EB, Levy MG, et al. Diarrhea associated with trichomonosis in cats. J Am Vet Med Assoc 2009;215:1450-1455.
- Lappin MR. Trichomoniasis. In: Sykes JE, ed. Canine and Feline Infectious Diseases. St Louis: Saunders 2014;779-783.
- Gookin JL, Levy MG, Law JM, et al. Experimental infection of cats with Tritrichomonas foetus. Am J Vet Res 2001;62:1690-1697.
- Yaeger M, Gookin JL. Histologic features of Tritrichomonas foetus colitis in domestic cats. Vet Pathol 2005;42:797-804.
- Tolbert MK, Gookin JL. Mechanisms of Tritrichomonas foetus pathogenicity in cats with insights from venereal trichomonosis. J Vet Intern Med 2016;30:516-552.
- Van der Saag M, McDonell D, Slapeta J. Cat genotype Tritrichomonas foetus survives passage through the alimentary tract of two common slug species. Vet Parasitol 2011;177:262-266.
- Hale S, Norris JM, Slapeta J. Prolonged resilience of Tritrichomonas foetus in cat feces at ambient temperature. Vet Parasitol 2009;166:60-65.
- Gookin JL, Stauffer SH, Levy MG. Identification of Pentatrichomonas hominis in feline fecal samples by polymerase chain reaction assay. Vet Parasitol 2007;145:11-15.
- Foster DM, Gookin JL, Poore MF, et al. Outcome of cats with diarrhea and Tritrichomonas foetus. J Vet Intern Med 2003;17:380.
- Gookin JL, Birkenheuer AJ, Breitschwerdt EB, et al. Single-tube nested PCR for diagnosis of Tritrichomonas foetus in feline feces. J Clin Microbiol 2002;40:4126-4130.
- Stauffer SH, Birkenheuer AJ, Levy MG, et al. Evaluation of four DNA extraction methods for the detection of Tritrichomonas foetus in feline stool specimens by polymerase chain reaction. J Vet Diagn Invest 2008;20:639-641.
- Gookin JL, Birkenheuer AJ, St. John V, et al. Molecular characterization of trichomonads from feces of dogs with diarrhea. J Parasitol 2005; 91:939-943.
- Gookin JL, Foster DM, Poore MF, et al. Use of a commercially available culture system for diagnosis of Tritrichomonas foetus infection in cats. J Am Vet Med Assoc 2003;222:1376-1379.
- Gookin JL, Copple CN, Papich MG, et al. Efficacy of ronidazole for treatment of feline Tritrichomonas foetus infection. J Vet Intern Med 2006;20:536-543.
- LeVine DN, Papich MG, Gookin JL, et al. Ronidazole pharmacokinetics after intravenous and oral immediate-release capsule administration in healthy cats. J Feline Med Surg 2011;13:244-250.
- Rosado TW, Specht A, Marks SL. Neurotoxicosis in 4 cats receiving ronidazole. J Vet Intern Med 2007;21:328-331.
- Foster DM, Gookin JL, Poore MF, et al. Outcome of cats with diarrhea and Tritrichomonas foetus. J Am Vet Med Assoc 2004;225:888-892.




 1999
1999  11 мин
11 мин





.png)


.png)



