Синтез и метаболизм витамина D
У животных многих видов биосинтез витамина D начинается под воздействием ультрафиолетового света, при котором 7-дегидрохолестерин превращается в провитамин D3. На синтез витамина D3 влияют количество и качество ультрафиолетовых лучей, тип кожи животного, а также пигментация кожи. У собак, в отличие от человека (и многих других видов), способность синтезировать витамин D3 в коже снижена — вероятно, вследствие высокой активности фермента 7-дегидрохолестерин-дельта-7-редуктазы. По этой причине собакам для удовлетворения пищевых потребностей требуется дополнительное потребление витамина D с кормом. В продуктах питания витамин D присутствует в двух основных формах: холекальциферол (витамин D3), обычно содержащийся в продуктах животного происхождения, и эргокальциферол (витамин D2), обычно из растительных источников.
В готовых кормах для собак витамин D входит в состав различных ингредиентов (например, внутренних органов или продуктов из жирной рыбы) или включается в виде добавок холекальциферола. Согласно действующим рекомендациям AAFCO1, минимально и максимально допустимый уровень потребления витамина D составляет 125 МЕ и 750 МЕ на 1000 килокалорий, соответственно. Хотя концентрация холекальциферола в большинстве готовых кормов для собак лишь в минимальной степени влияет на концентрацию 25(OH)D в сыворотке крови, потребление витамина D с кормом может изменять эти показатели при его введении в достаточно больших количествах (до 2700 МЕ/кг массы тела) (1). Врачи должны знать, что эта доза намного превышает безопасный верхний предел, установленный Национальным исследовательским советом США (National Research Council — NRC) и равный 2,6 мкг (т. е. 104 МЕ) на кг массы тела (МТ)0,75.
Попав в организм, витамин D через систему воротной вены печени и лимфатические сосуды кишечника переносится в печень (Рисунок 1). В этом процессе участвуют пищеварительные ферменты, хиломикроны, желчные кислоты, витамин D-связывающий белкок (vitamin D-binding protein — VDBP) и транскальциферин. В печени холекальциферол гидроксилируется 25-гидроксилазой с образованием 25(OH)D (также называемого кальцидиолом или кальцифедиолом), который связывается с VDBP в крови. Период полувыведения 25(ОН)D составляет примерно 2–3 недели, и его считают самым надежным показателем системного уровня витамина D.
Затем 25(ОН)D гидроксилируется (ферментом 1α-гидроксилазой) с образованием 1,25(ОН)2D (кальцитриола), наиболее активного природного метаболита витамина D, воздействующего на множество клеток-мишеней по витамин D-рецептор (VDR)-опосредованному механизму (Рисунок 1). Кальцитриол связывается с VDR значительно лучше (примерно в 500 раз), чем витамин D3 или 25(OH)D. Активация 1,25(OH)2D происходит преимущественно в почках, а также в других тканях, экспрессирующих 1α-гидроксилазу. У собак экспрессия VDR выявлена в нескольких видах тканей, особенно в почках, двенадцатиперстной кишке, коже, подвздошной кишке и селезенке. Хотя точный механизм полностью не изучен, активность 1α-гидроксилазы жестко регулируется сывороточными концентрациями кальция, паратгормона (ПТГ), 1,25 (OH)2D, фактора роста фибробластов-23 (FGF-23) и активностью фермента Клото (Klotho). Внутри клетки 1,25 (OH)2D может повышать или подавлять транскрипцию и экспрессию соответствующего гена. Как 25(OH)D, так и 1,25(OH)2D инактивируются 24-гидроксилазой с образованием 24,25(ОН)2D и 1,24,25-тригидроксивитамин D, соответственно, и других метаболитов (например, 25[ОH]D–23,23 лактон), выводимых из организма с мочой и желчью.
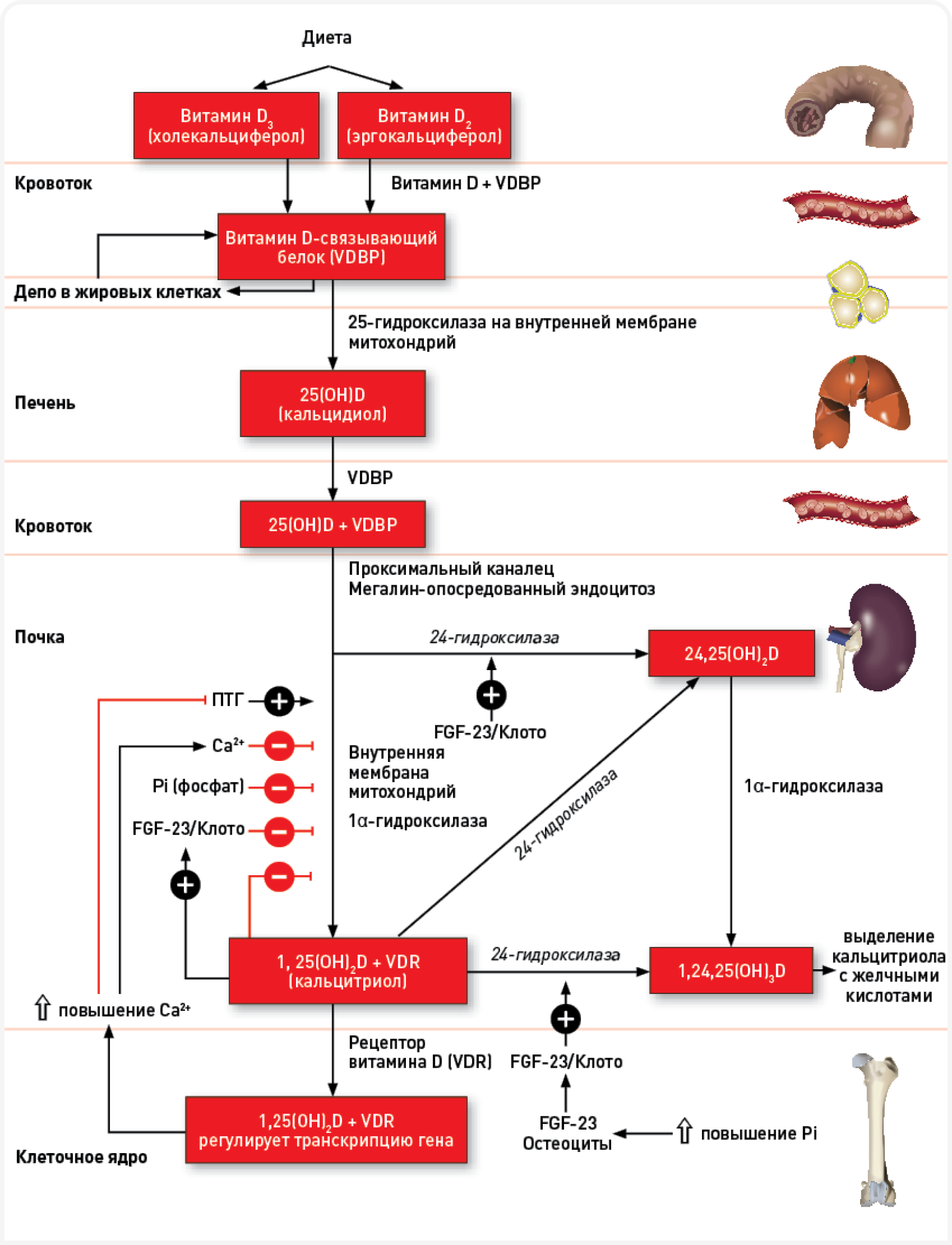
Рисунок 1. Схема метаболизма витамина D, начиная с поступления с кормом и до метаболизации в печени и почках. Черными линиями и знаками (+) показаны стимулы, а красными линиями и знаками (-) – отрицательная обратная связь или снижение активности. Обратите внимание также на влияние неорганического фосфата (Pi), ионизированного кальция (Ca2+), FGF-23, фермента Клото, ПТГ.
1. AAFCO — Американская ассоциация контроля качества пищевой продукции
Уровень метаболитов витамина D при различных заболеваниях
Болезни почек
Уровни метаболитов витамина D измеряли у собак с рядом заболеваний почек, включая острую почечную недостаточность, хроническую болезнь почек (ХБП) и протеинурическую болезнь почек. У собак с ХБП концентрации 25(OH)D и 1,25(OH)2D оказались ниже, чем у собак в контроле (3–5). Метаболиты витамина D коррелируют со стадией заболевания почек (определяемой по критериям Международного общества изучения заболеваний почек — IRIS), о чем свидетельствует значительное снижение концентраций 25(OH)D, 1,25(OH)2D и 24,25(OH)2D у собак при 3-й стадии болезни почек по сравнению с контролем (3,4). Однако в других исследованиях у многих собак концентрации 25(OH)D и 1,25(OH)2D оказались в пределах референсных диапазонов (6, 7). Одним из возможных объяснений такого отсутствия различий может быть включение в исследования собак с ХБП на более ранних стадиях. С другой стороны, значимые различия концентраций метаболитов витамина D, возможно, не были обнаружены из-за относительно широких референсных диапазонов или метода расчета референсных диапазонов.
Одним из последствий ХБП оказывается развитие вторичного гиперпаратиреоза и индуцированных ХБП нарушений минерального обмена и поражений костной ткани (Рисунок 2). У собак с ХБП концентрация FGF-23 в плазме увеличивается, причем концентрация FGF-23 отрицательно коррелирует с уровнями 25(ОН)D, 1,25(ОН)2D и 24,25(ОН)2D и выживаемостью (4,8). Уже несколько десятилетий действуют рекомендации по лечению собак с ХБП кальцитриолом для снижения концентрации ПТГ и повышения качества жизни. Тем не менее, для определения влияния добавок с различными формами витамина D на концентрацию FGF-23, экспрессию фермента Клото, насыщение витамином D, качество жизни, сохранение функции почек и на выживаемость необходимы проспективные контролируемые клинические исследования.
Наконец, при острой почечной недостаточности у собак концентрации 25(OH)D и 1,25(OH)2D оказались значительно ниже, чем у контроля, но в большинстве (7/10) случаев острой почечной недостаточности у собак эти концентрации не выходили за пределы референсных диапазонов (6). Эти результаты могут быть обусловлены острым воспалением или терминальной стадией заболевания, или просто оказаться ложными. При протеинурии у собаки концентрации 25(OH)D, 1,25(OH)2D и 24,25(OH)2D значительно ниже, чем в контроле. Эта связь окончательно установлена у людей, страдающих протеинурией, и в таких случаях для уменьшения протеинурии часто назначают активаторы VDR.
Существует несколько механизмов нарушения метаболизма витамина D при заболеваниях почек, в том числе снижение поступления витамина D с кормом, снижение его ферментативного превращения из холекальциферола в 25(ОН)D в печени, снижение активации посредством 1α-гидроксилазы из 25(ОН)D в 1,25(OH)2D и повышение инактивации 25(ОН)D и 1,25(OH)2D. При протеинурии могут действовать дополнительные механизмы, в том числе выведение VDBP с мочой (при этом с VDBP связываются 25(ОН)D и 1,25(OH)2D) и снижение эндоцитоза 25(ОН)D внутри почечных клеток вследствие снижения экспрессии мегалина в проксимальных почечных канальцах. Кроме того, концентрация 25(OH)D может снизиться вследствие воспаления.
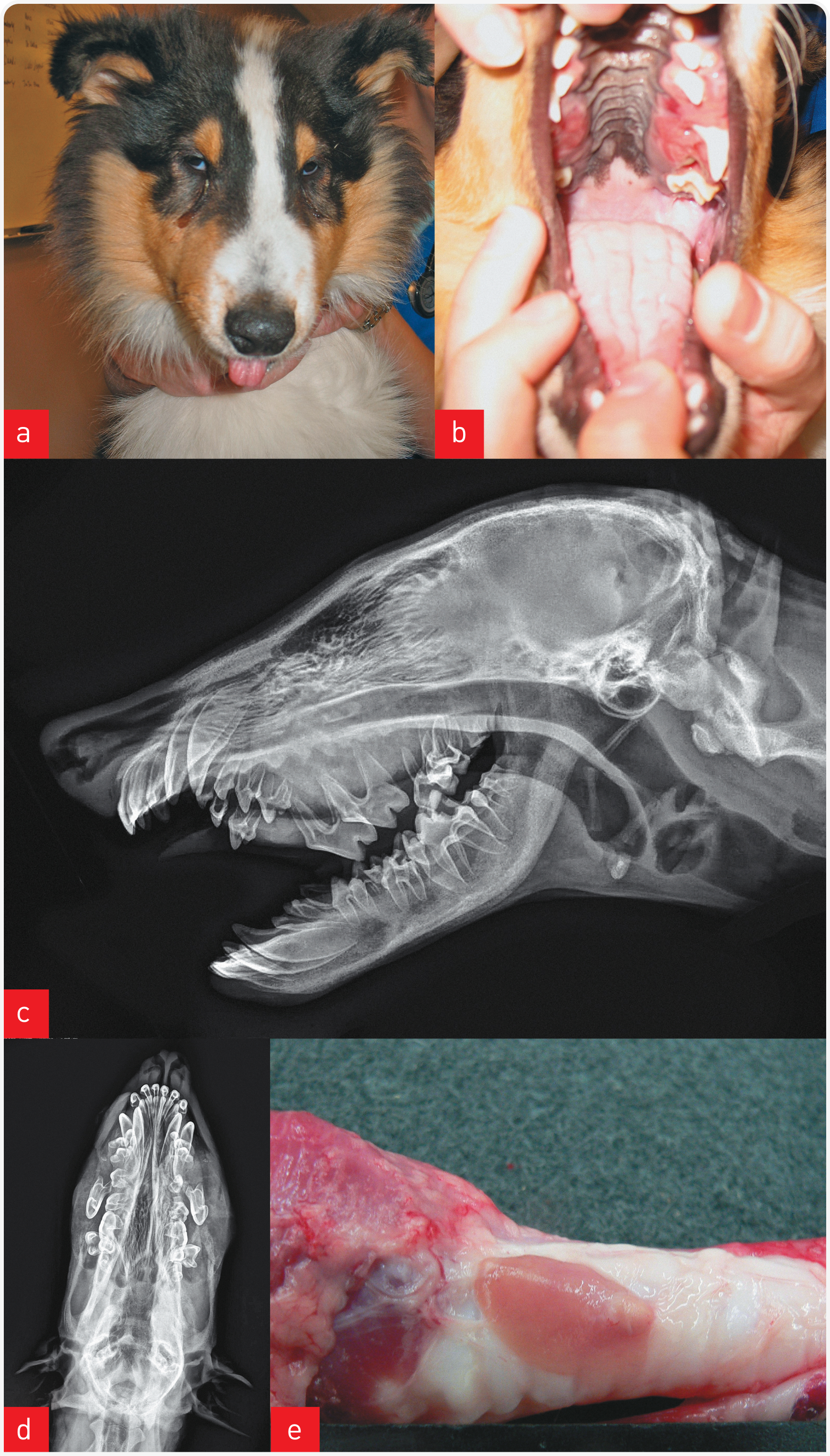
Рисунок 2. Кобель колли, возраст 5 месяцев, поступил по поводу увеличения в размерах верхней челюсти (а). Причиной оказалась врожденная дисплазия почек, осложнившаяся нефрогенным вторичным гиперпаратиреозом (то есть синдром минеральных и костных нарушений при хронической болезни почек). При обследовании верхней челюсти выявлена фиброзная остеодистрофия (b), подтвержденная гистологически. При рентгенографии костей черепа (c, d) выявлена выраженная потеря нормальной ткани альвеолярной кости с вентролатеральным смещением большинства премоляров и моляров верхней челюсти, массивным отеком прилежащих мягких тканей, проявляющимся «флотированием» зубов в мягких тканях. При посмертном исследовании выявлена гиперплазия паращитовидных желез на фоне врожденной дисплазии почек и хронической болезни почек (е).
Новообразования
У человека показано, что снижение концентрации 25(OH)D сопровождается повышением риска развития многих новообразований, а 1,25(OH)2D обладает противоопухолевой активностью. Концентрации метаболитов витамина D в крови были измерены у собак с различными опухолями и концентрация 25(OH)D в сыворотке при многих опухолевых заболеваниях оказалась значительно снижена, в том числе у собак с новообразованием и гемоабдоменом, с кожными тучноклеточными опухолями, и лимфомой. Неясно, будет ли гиповитаминоз D у собак вторичным на фоне новообразований или фактором риска их развития. При новообразованиях у собак часто развиваются сопутствующие заболевания; при этом снижается аппетит и увеличивается риск развития гиповитаминоза D, что приводит к снижению поступления в организм холекальциферола. Возможно, также снижается интенсивность всасывания холекальциферола в кишечнике. Недавно было высказано предположение, что изменение концентрации 25(OH)D у собак при различных новообразованиях опосредуется концентрацией ионизированного кальция (9).
При измерении в популяциях собак, больных лимфомой, как с гиперкальциемией, так и без неё, сывороточные уровни 1,25(OH)2D значительно различались. С точки зрения противоопухолевого действия выявлено, что у собак кальцитриол in vitro может подавлять рост остеосаркомы, плоскоклеточного рака, рака из эпителиальных клеток предстательной железы, переходно-клеточной аденокарциономы, рака молочной железы и мастоцитомы определённых клеточных линий. В одном исследовании показали, что у собак введение кальцитриола с цисплатином обеспечивает синергетическое действие в отношении различных опухолей (например, остеосаркомы и хондросаркомы) (10). В другом исследовании обнаружили, что лечение кальцитриолом может вызвать ремиссию тучноклеточных опухолей (мастоцитом), но исследование было прекращено из-за высокой токсичности лечения (т. е. развития гиперкальциемии и азотемии) (11).

«
«Гомеостаз витамина D реализуется в организме через множество сложных взаимодействий, и возможны различные пути нарушений регуляторных механизмов. При ряде заболеваний концентрации метаболитов витамина D снижаются, а при других — повышаются».
Валери Дж. Паркер
Первичный гиперпаратиреоз
Хотя первичный гиперпаратиреоз теоретически относят к неопластическим состояниям, здесь, чтобы избежать путаницы со злокачественными заболеваниями, мы рассмотрим его отдельно, поскольку у собак первичный гиперпаратиреоз в большинстве случаев сопровождается доброкачественными аденомами паращитовидной железы. По сравнению с контролем, у пяти собак с первичным гиперпаратиреозом концентрация 25(OH)D в сыворотке крови оказалась значительно ниже (7), хотя все значения у больных собак находились в пределах референсных диапазонов. Сывороточная концентрация 1,25(OH)2D также была значимо выше у собак с первичным гиперпаратиреозом, чем в контроле, и концентрация 1,25(OH)2D у 4 из 5 собак с первичным гиперпаратиреозом оказалась выше референсных пределов (7). Оба эффекта можно объяснить активацией почечной 1α-гидроксилазы под действием ПТГ, что приводит к увеличению синтеза 1,25(OH)2D.
В одном исследовании у 10 собак с первичным гиперпаратиреозом, которым проводили хирургическое иссечение аденом паращитовидной железы, во всех случаях концентрация 25(OH)D на момент диагностики оказались ниже, чем в контроле, в то время как концентрация 1,25(OH)2D находилась в пределах референсных диапазонов. На момент максимального снижения концентрации ионизированного кальция после паратиреоидэктомии концентрация 25(OH)D не отличалась от выявленной на момент установления первоначального диагноза, однако средняя концентрация 1,25(OH)2D была ниже (12).
Традиционно первичный гиперпаратиреоз диагностируют при выявлении повышенной концентрации ионизированного кальция на фоне неадекватно высокой концентрации ПТГ. В организме человека концентрация 25(OH)D в крови играет важную роль в регуляции подавления синтеза ПТГ (вероятно, после его преобразования в 1,25(ОН)2D в паращитовидной железе). Концентрации ПТГ выше у людей с более низкими уровнями 25(OH)D в крови. В настоящее время у людей рекомендуется ставить диагноз первичного гиперпаратиреоза только тогда, когда концентрация 25(ОН)D в организме достаточна или после того как концентрация 25(ОН)D нормализуется на фоне приема добавок с витамином D. Значение одновременной оценки концентрации ионизированного кальция, ПТГ и 25(OH)D для точной диагностики первичного гиперпаратиреоза в ветеринарии до настоящего времени не изучено.
Заболевания желудочно-кишечного тракта
Всасывание жирорастворимых витаминов зависит от адекватного усвоения жиров, поступающих с кормом. В связи с этим при заболеваниях кишечника, сопровождающихся нарушением всасывания, уровни абсорбции витамина D могут снижаться, что в конечном счете способствует развитию гиповитаминоза D. У собак с воспалительным заболеванием кишечника (ВЗК) и энтеропатией с потерей белка (ЭПБ) определяли концентрации 25(ОН)D и 1,25(OH)2D в сыворотке крови, и оба показателя были статистически значимо ниже при ЭПБ по сравнению с ВЗК и здоровыми собаками (13,14). Кроме того, более низкие концентрации 25(OH)D статистически значимо коррелировали с показателями воспаления двенадцатиперстной кишки и смертностью (14–16).
Возможно, гипоальбуминемия способствует развитию гиповитаминоза D по механизму потери VDBP через толстый отдел кишечника. Кроме того, гиповитаминоз D может способствовать потере белков в кишечнике путем влияния витамина D на иммунные реакции. Известно, что у мышей с нокаутным геном рецептора витамина D индуцированное ВЗК развивается чаще, а при диетах с дефицитом витамина D мыши более предрасположены к развитию колита вследствие нарушения регуляции антимикробной активности содержимого просвета толстой кишки и нарушения гомеостаза кишечных бактерий (17).
Ортопедические заболевания
Остеобласты и хондроциты экспрессируют 1α-гидроксилазу и VDR, но неизвестно, является ли участие витамина D в росте и минерализации костей прямым или косвенным. Рахит — это нарушение обмена веществ в костной ткани, обычно развивающееся при дефиците витамина D, кальция или фосфора в рационе или при генетически обусловленных нарушениях их обмена (Рисунок 3). Клинически рахит обычно проявляется расширением метафизарной пластинки роста у быстрорастущих костей, например, лучевой и локтевой. Гистологически, в тканях накапливаются гипертрофированные хондроциты, что приводит к утолщению и искривлению пластинок роста. При несбалансированных рационах с преобладанием мяса без добавки витамина D чаще развивается не рахит, а фиброзная остеодистрофия, вызванная пищевым гиперпаратиреозом. Лечение рахита, вызванного несбалансированным кормлением, состоит в переходе к полноценному и сбалансированному питанию.
У человека описаны два аутосомно-рецессивных заболевания, вызывающих витамин D-зависимый рахит (VDDR). VDDR типа 1 вызван дефектом гена, кодирующего 1α-гидроксилазу, что впоследствии приводит к неадекватной активации 25(OH)D с образованием 1,25(OH)2D. Поэтому концентрация 25(OH)D оказывается в пределах референсного диапазона, а концентрация 1,25(OH)2D остается низкой. VDDR типа 2 вызван дефектом гена VDR, вызывающим гипокальциемию, вторичный гиперпаратиреоз и высокую концентрацию 1,25(ОН)2D. У собак описано несколько случаев развития обоих типов VDDR (18,19). Лечение VDDR типа 1 включает дополнительное назначение 1,25(OH)2D. Как правило, прогноз более благоприятный, чем при VDDR типа 2, при котором требуется назначать высокие дозы и 1,25(ОН)2D,и кальция. У человека большинство мутаций приводят к дефекту гена VDR, в результате чего он перестает отвечать даже на высокие дозы 1,25(OH)2D. У детей лечение высокими дозами 1,25(OH)2D иногда дает результаты: таким образом, последствия дефекта в форме ингибирования сродства к 1,25(OH)2D удается преодолеть.
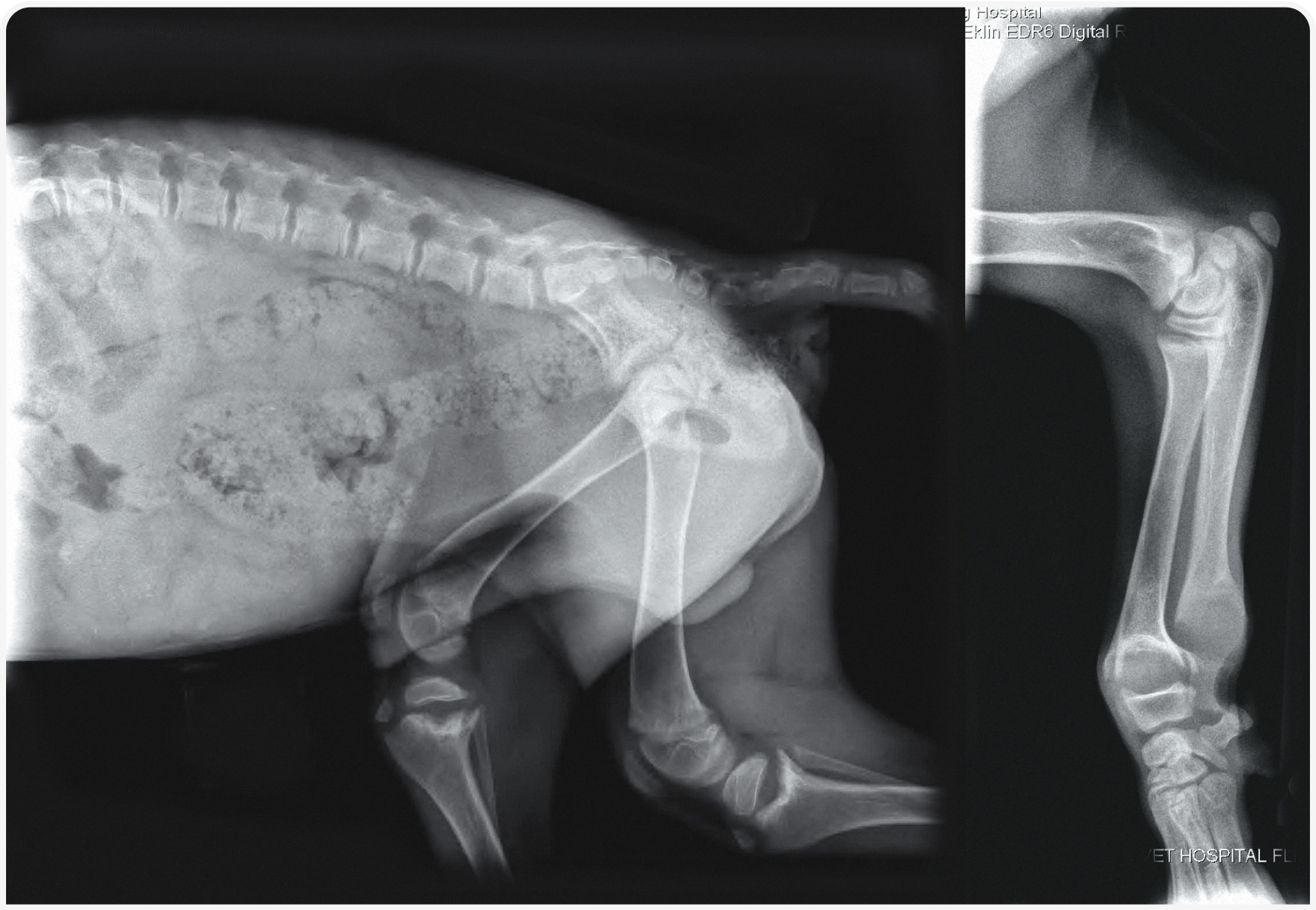
Рисунок 3. Рентгенограммы таза в правой боковой проекции и лучевой/локтевой костей молодой (предположительно годовалой) собаки. Пластинки роста лучевой, локтевой и большеберцовой костей значительно расширены и имеют чашеобразную форму, что сопровождается диффузной остеопенией. Эти данные соответствуют диагнозу рахит.
Сердечно-сосудистые заболевания
Витамин D играет в патогенезе заболеваний сердца важную роль. Кардиомиоциты экспрессируют VDR и кальцитриол-зависимый кальцийсвязывающий белок. У человека гиповитаминоз D сопровождается повышением частоты развития инфаркта миокарда и сердечно-сосудистых осложнений. Также у людей описан обратно пропорциональный характер связи уровней витамина D и гипертонии, но мета-анализ данных 46 исследований показал, что добавки с витамином D не снижают артериальное давление (20). В исследованиях у собак четкой связи между гипертонией и витамином D выявлено не было.
Изучена связь витамина D с болезнями сердца у собак. В одном исследовании у 31 собаки, страдавшей застойной сердечной недостаточностью, средние уровни 25(OH)D в сыворотке были примерно на 20% ниже, чем у здоровых собак в контроле (21). В другом исследовании показали, что сывороточные концентрации 25(OH)D были статистически значимо ниже у собак с хроническими клапанными пороками стадий B2, C, D (по критериям Американской коллегии специалистов по лечению внутренних болезней животных, ACVIM) по сравнению с собаками с хроническими клапанными пороками на стадии B1 (т. е. в отсутствие признаков ремоделирования миокарда). Сывороточные концентрации 25(OH)D статистически значимо коррелировали с размерами левого желудочка и предсердий (21). Как и при других заболеваниях, снижение сывороточных концентраций 25(OH)D может быть связано с уменьшением поступления витамина D с кормом или с повышением активности воспалительных процессов. Насколько известно автору, ветеринарных исследований связи концентраций FGF-23 или фермента Клото с сердечно-сосудистыми заболеваниями не проводили, хотя при ХБП у людей как для FGF-23, так и для фермента Клото установлена связь с сердечно-сосудистыми заболеваниями (в частности, атеросклерозом, снижением эластичности стенок сосудов, гипертрофией левого желудочка).
Воспалительные состояния
Витамин D связан с воспалительными процессами и иммунной системой, поскольку большинство лейкоцитов экспрессируют VDR. Уровень 25(OH)D в сыворотке — показатель воспаления, у человека обычно изменяющийся обратно пропорционально белкам острой фазы (например, C-реактивному белку — СРБ). Кроме того, 25 (OH)D и 1,25(OH)2D регулируют активность воспаления путем ингибирования выработки интерлейкина-6 и фактора некроза опухоли-α. После напряженных гонок, несмотря на более высокие концентрации СРБ, у ездовых собак обнаруживали более высокие концентрации 25(OH)D (23).
Корреляции между концентрациями 25(OH)D и СРБ у страдающих раком собак не выявлено (2). В отношении лейкоцитарного звена иммунитета выявлено, что при хронической энтеропатии у собак концентрации 25(OH)D в сыворотке статистически значимо отрицательно коррелируют с количеством нейтрофилов, количеством моноцитов и концентрациями интерлейкинов-2 и — 8 (15).
Другие взаимосвязи
Исследованы сывороточные концентрации 25(OH)D при ряде инфекционных заболеваний собак. У собак с опухолевым и неопухолевым спироцеркозом уровни 25(OH)D оказались статистически значимо ниже, чем у здоровых собак; при опухолевом спироцеркозе уровни 25(OH)D у собак оказались статистически значимо ниже, чем при неопухолевом (24). При гранулематозных заболеваниях у собак может развиться гиперкальциемия. Вначале считали, что она вызвана главным образом нарушением регуляции выработки кальцитриола (например, увеличением выработки 1,25(OH)2D), однако и у человека, и у собак описаны гранулематозные заболевания, при которых гиперкальциемия связана не с кальцитриолом, а с ПТГ-связанным пептидом.
Наконец, у собак при остром полирадикулоневрите концентрации 25(OH)D оказались ниже, чем при эпилепсии (24). Значение этого наблюдения остается неизвестным.
Добавки витамина D и его токсическое действие
В ряде исследований выявлено, что у собак с различными заболеваниями концентрации метаболитов витамина D снижаются; однако необходимость назначения таким животным добавок с витамином D или метаболитов витамина D не определена, а при целесообразности их назначения не установлены наилучшие способы их применения. Можно назначать витамин D2 (эргокальциферол), витамин D3 (холекальциферол), кальцидиол, кальцитриол или другие активаторы VDR (например, парикальцитол).
В проспективном исследовании при атопическом дерматите у собак зуд и показатели выраженности поражений при приеме холекальциферола снижались (1). Здесь наблюдалась только минимальная токсичность холекальциферола, но для влияния его на концентрацию 25(OH)D в сыворотке крови и на клинические признаки требовались чрезвычайно высокие дозы (до 1400 МЕ/кг, что выше доз, рекомендованных AAFCO или указанных в NRC). Недавно для лечения прогрессирующей ХБП у человека была одобрена лекарственная форма препарата с регулируемым высвобождением 25(OH)D4. Дополнительное назначение 25(OH)D собакам увеличивает концентрации 25(OH)D в сыворотке крови быстрее и эффективнее, чем назначение холекальциферола, но для разработки соответствующих рекомендаций по дозированию необходимы дополнительные исследования.
Целью назначения добавок с витамином D или 25(OH)D должно быть увеличение концентрации 25(OH)D в сыворотке крови и улучшение исходов основного заболевания (например, уменьшение зуда или увеличение выживаемости, или продолжительности жизни). Витамин D может применяться в разных лекарственных формах с разными периодами полувыведения и риском развития токсичных эффектов, поэтому назначать их следует с осторожностью и тщательно контролировать состояние животных во время лечения.
Токсическое действие витамина D чаще всего диагностируют после развития гиперкальциемии, сопровождающейся риском острого повреждения почек и развития минерализации мягких тканей. Развитие гиперкальциемия при токсическом действии витамина D обнаруживается относительно поздно. Риск развития токсического действия витамина D определяется рядом факторов, в том числе липофильностью, сродством метаболитов витамина D к VDBP и скоростью синтеза и разрушения метаболитов. Витамин D жирорастворимый, и в основном поэтому период его полувыведения из организма длителен, около 2 месяцев. Периоды полувыведения 25(OH)D и 1,25 (OH)2D составляют приблизительно 2–3 недели и 4–6 часов, соответственно.
У человека токсическое действие витамина D, приводящее к развитию гиперкальциемии, возникает при концентрациях 25(OH)D в сыворотке выше 100–150 нг/мл. В исследованиях у животных различных видов (крыс, коров, свиней, кроликов, собак и лошадей) концентрации 25(OH)D в плазме при гиперкальциемии превышают 150 нг/мл. Наиболее часто токсическое действие витамина D у собак развивается при проглатывании родентицидов (крысиных ядов) с холекальциферолом (Рисунок 4) и кремов для кожи с кальцитриолом или его аналогами (кальципотриолом и кальципотриеном). Иногда токсическое действие витамина D может быть обусловлено и ошибками в формулах продуктов, вызывающих его избыточное содержание в готовых кормах для домашних животных. Ятрогенное токсическое действие, обычно определяемое путём измерения концентрации 1,25(OH)2D, наблюдается при назначении добавок с кальцитриолом для лечения вторичного нефрогенного гиперпаратиреоза, первичного гипопаратиреоза, ЭПБ, при пред — или постоперационном лечении первичного гиперпаратиреоза.
Следует отметить, что гиперкальциурия развивается на ранних стадиях токсического воздействия витамина D, до развития гиперкальциемии, и может оказывать неблагоприятное влияние, увеличивая риск повреждения почек и образования кальцийсодержащих мочевых камней. У человека гиперкальциурию выявляют, используя соотношение концентраций кальция и креатинина в моче, которое предложено также применять и для обследования собак с обнаруженными уролитами, содержащими кальций.

Рисунок 4. Если собака подобрала с земли и проглотила родентицид (крысиный яд) с холекальциферолом, то может иметь место токсическое действие витамина D.
4. RayaLdee, OPKO Healthy Inc, Майами, штат Флорида, США.




 4731
4731  12 мин
12 мин








.png)








