Введение
Липидоз печени (ЛП) был впервые описан в 1977 году и с тех пор стал наиболее часто диагностируемым заболеванием гепатобилиарной системы у кошек (1, 2). Накопление триглицеридов в гепатоцитах приводит к их набуханию и внутрипеченочному холестазу, окислительному повреждению, вторичному воспалению и в конечном счете нарушению функции печени (1, 2).
Метаболические осложнения и системные последствия ЛП весьма разнообразны и включают электролитный дисбаланс, инсулинорезистентность, панкреатит, гипераммониемию, печеночную энцефалопатию, коагулопатии. Таким образом, липидоз печени кошек (ЛПК) сопровождается значительной частотой развития осложнений и часто требует госпитализации для первоначальной стабилизации состояния, причем для полного выздоровления может потребоваться несколько недель интенсивного лечения с общим прогнозом от осторожного до благоприятного.
ЛП кошек определяют как патологическое накопление заполненных липидами вакуолей в гепатоцитах. При тяжелом заболевании жир составляет более 30% от общей массы печени, при том что в норме содержание жира в ткани печени редко превышает 1–5% (3, 4). Из жиров при ЛПК преобладают триглицериды, образующиеся в жировой ткани в результате усиленного липолиза во время катаболических состояний при голодании, а не синтеза триглицеридов в печени de novo (2, 3).
Кроме того, развитию ЛПК способствуют нарушение процессов окисления и утилизации жира в гепатоцитах, уменьшение перераспределения жира из печени в периферические ткани, изменения метаболизма липопротеинов (4, 5).
Вопрос об индивидуальной предрасположенности к развитию ЛПК спорный; в небольшом числе сообщений отмечена большая распространенность у самок по сравнению с самцами (1, 6, 7), но явной гендерной или породной предрасположенности нет. Из факторов риска для развития ЛПК, вероятно, наиболее важно ожирение, обусловленное исходными нарушениями липидного и углеводного обмена и более высокими запасами жира (2).
Тем не менее показано, что ЛП развивается независимо от кондиции тела (8), и при выявлении соответствующих диагнозу ЛПК анамнестических, клинических и лабораторных данных всегда следует исключать этот диагноз.
В эксперименте было показано, что ЛП развивается после нескольких недель ограниченного потребления калорий, но в клинических условиях его диагностируют даже при предшествующих в течение всего двух дней периодах анорексии (1, 6, 7, 9). Однако эти сообщения субъективны и основаны на мнении владельца о потребленном кошкой количестве корма, поэтому их следует интерпретировать с осторожностью.
ЛП развивается при снижении потребления энергии более чем на 50% от базовых энергетических потребностей, но важны не только калорийность, но и состав рациона (2). При дефиците незаменимых аминокислот (АК) в пище повышается риск накопления липидов в печени, и добавление L-карнитина может предотвратить развитие ЛПК даже при значительно сниженной калорийности (2, 10).
Кошки — облигатные хищники, и их организм плохо или вообще не синтезирует многие незаменимые жирные кислоты и АК.
Кроме того, метаболизм углеводов у кошек отличается от такового у всеядных видов животных: у кошек ниже общая потребность организма в углеводах, вместо углеводов для получения энергии больше используются жиры и белки, и нормогликемия поддерживается преимущественно благодаря АК-зависимым механизмам глюконеогенеза (1, 2).
Эти особенности метаболизма отражаются в их рационе, который в основном состоит из белков и жиров, и, возможно, также объясняют, почему при недостатке пищи у них в печени накапливается жир. По сравнению с собаками и человеком, у кошек снижена эндогенная выработка нескольких длинноцепочечных полиненасыщенных жирных кислот. Эти жирные кислоты защищают от ЛП, способствуя окислению триглицеридов и синтезу гликогена, а не липогенезу, но при снижении потребления с пищей жиров их защитные свойства утрачиваются, что может способствовать развитию ЛПК (1).
У кошек также ограничена способность синтезировать аргинин, метионин, цистеин и таурин. Недостаток этих незаменимых АК препятствует бета-окислению неэтерифицированных жирных кислот (NEFA), уменьшает выработку частиц липопротеинов очень низкой плотности, переносящих триглицериды из печени в остальные ткани, и снижает выработку эндогенного L-карнитина, тем самым нарушая перенос NEFA в митохондрии (1, 2).
Наконец, при ожирении и ЛП у кошек часто нарушаются секреция инсулина и реактивность периферических тканей (4), способствуя липолизу и мобилизации NEFA из них. В совокупности к развитию ЛПК приводят недостаточность этих питательных веществ, нарушения метаболизма и гормональные изменения.
Анамнез и клинические проявления
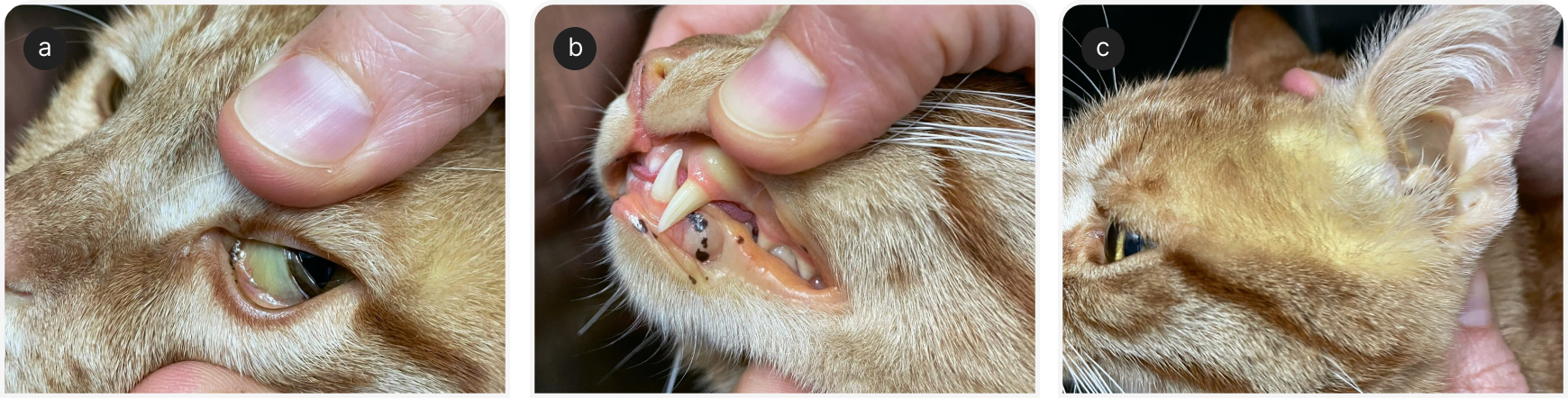
Развитию ЛПК всегда предшествуют длительные периоды гипорексии/анорексии (6, 7, 9), которые, в свою очередь, могут быть вызваны непреднамеренным лишением пищи, снижением вкусовых качеств кормов или стрессовыми ситуациями (например, пребывание в зоогостинице, смена владельца, переезд в новый дом). Если выявлено первичное заболевание, ставится диагноз вторичного ЛПК; его частота составляет 50–95% (1, 6, 7, 9). Таким образом, необходимо постараться выявить и устранить возможную первопричину, для чего следует провести тщательный опрос владельца и диагностическое обследование животного (Таблица 1). Снижение потребления калорий неизменно приводит к потере веса. Даже у кошек с нормальной, по мнению владельца, массой тела при более тщательном непосредственном обследовании часто выявляют снижение кондиции тела и саркопению, особенно в задних конечностях и мышцах спины. К распространенным симптомам относят летаргию, слабость, желудочно-кишечные нарушения (например, рвоту, диарею, запор), обезвоживание, гепатомегалию. Желтуха встречается часто и лучше всего видна на слизистых, склере, ушных раковинах (6, 7, 9) (Рисунок 1). Птиализм (слюнотечение), хотя и является неспецифичным признаком, может быть единственным клиническим проявлением печеночной энцефалопатии (ПЭ) при ЛПК и встречается в небольшой части случаев. Птиализм при первичном осмотре сопровождается менее благоприятным исходом (9). Другие причины птиализма: заболевания полости рта, тошнота, идиосинкразия при приеме лекарств внутрь. Дополнительные, менее частые клинические проявления могут возникать при осложнениях ЛПК (например, при геморрагическом диатезе, ПЭ, синдроме хрупкости кожи) или в рамках первичного заболевания (например, лихорадка при инфекциях или воспалительных заболеваниях, таких как панкреатит, полиурия и полидипсия у кошек с заболеваниями почек или диабетом и т. д.).
Биохимически ЛПК проявляется повышением активности щелочной фосфатазы (ЩФ), наблюдаемым у > 80% заболевших кошек (7, 9, 11). Экспериментально установлено, что повышение уровня ЩФ предшествует развитию гипербилирубинемии (8), и его считают высокочувствительным и довольно специфичным маркером ЛПК. И наоборот, активность гамма-глутамилтранспептидазы (ГГТ) повышается редко и в основном на фоне сопутствующих холестаза / патологии желчевыводящих путей (11).
Таким образом, значимое повышение активности ЩФ на фоне нормальной или слегка повышенной активности ГГТ свидетельствует о наличии ЛПК. Тем не менее в дифференциальный диагноз повышения активности ЩФ включают гепатобилиарные (например, холангиогепатит, обструкцию желчевыводящих путей) и гормональные (например, гипертиреоз) заболевания.
Из неспецифических признаков часто выявляют гипербилирубинемию и повышение активности аланиновой (АЛТ) / аспарагиновой (АСТ) аминотрансфераз (7, 9). Накопление жира в печени, независимо от этиологии, вызывает отек гепатоцитов и внутрипеченочный холестаз, а также окислительное повреждение и вторичное воспаление ткани печени, приводящие к повышению активности трансаминаз, следовательно, аномальное повышение уровня печеночных трансаминаз не обязательно свидетельствует о дополнительной патологии печени. Повышение активности АЛТ/АСТ в несколько раз (относительно соответствующих норм) больше, чем активности ЩФ, может свидетельствовать о наличии еще одного первичного заболевания (7).
Возможно снижение концентрации мочевины в результате уменьшения потребления белка и нарушения биохимического цикла мочевины. Последнее усугубляется дефицитом аргинина и витамина В12, часто наблюдаемых при ЛПК. Аналогичным образом, на фоне печеночной недостаточности, дефицита витамина В12 и недостаточного потребления аргинина с пищей может развиться вторичная гипераммониемия, имеющая клиническое значение и требующая лечения (1, 2).
Другие, наблюдаемые редко нарушения неспецифичны: гипоальбуминемия/гипопротеинемия вследствие энтеропатии с потерей белка и/или недостаточности синтеза в печени, гипохолестеролемия или связанная с холестазом гиперхолестеринемия (7, 9). У кошек с ожирением, и особенно при ЛПК, часто встречается гипертриглицеридемия (12). На фоне резистентности к инсулину, панкреатита или сахарного диабета, сопровождающегося клиническими проявлениями, может развиться вторичная гипергликемия (7, 9). С другой стороны, гипогликемия наблюдается редко (9), но может возникать вторично на фоне печеночной недостаточности, сепсиса или панкреатита, и ее считают негативным прогностическим фактором (13).
Из нарушений электролитного обмена наиболее частым и клинически значимым проявлением ЛПК у кошек является гипокалиемия (1). Она часто осложняется мышечной слабостью, снижением способности почек концентрировать мочу с развитием полиурии/полидипсии, непроходимости желудка и кишечника, обострением ПЭ, а в более тяжелых случаях — дисфункцией сердца. Истинная величина дефицита калия при поступлении в клинику часто оказывается замаскирована обезвоживанием, а энтеральное и парентеральное питание может усугубить гипокалиемию (14, 15).
Поэтому концентрацию калия в крови крайне важно тщательно отслеживать и корректировать. Реже из электролитных нарушений выявляют гипомагниемию и гипофосфатемию (1, 14, 15). Они могут обнаруживаться при поступлении (на фоне потерь электролитов с фекалиями и мочой), но часто развиваются позже в ходе заболевания на фоне регидратации и начала парентерального или энтерального питания. Их развитие осложняется мышечными/сердечными и неврологическими проявлениями (гипофосфатемия и гипомагниемия), гемолитической анемией, тромбоцитопенией (гипофосфатемия), развитием рефрактерной гипокалиемии и гипокальциемии (гипомагниемия).
Изменения в общем анализе крови разнообразные и неспецифичные и могут быть следствием другого первичного заболевания или осложнения ЛПК. Изменения морфологии эритроцитов включают пойкилоцитоз, микроцитоз и тельца Хайнца (1, 6, 7). Последние появляются в результате окислительного стресса и гипофосфатемии и могут способствовать развитию анемии. С другой стороны, тяжелая гипофосфатемия может непосредственно привести к гемолитической анемии (14). Тяжелый микроцитоз указывает на дефицит железа или заболевания сосудов печени (например, портосистемные шунты).
При ЛП у кошек часто развиваются коагулопатии (1, 7); в одном отчете сообщалось, что аномальное повышение протромбинового времени (ПВ) и/или активированного частичного тромбопластинового времени (АЧТВ) наблюдалось более чем в 90% случаев (9). При сравнении результатов теста на белки, индуцируемые в отсутствии витамина К (proteins induced by vitamin K absence — PIVKA), и ПВ/АЧТВ (16) у кошек с заболеваниями печени и кишечника чувствительность первого для выявления коагулопатий, связанных с витамином К, была значительно выше.
Однако, поскольку тестов измерения PIVKA в настоящее время на рынке нет, а также учитывая высокую распространенность коагулопатий и дефицита витамина К при ЛПК, рекомендуется назначение витамина К (Таблица 2).
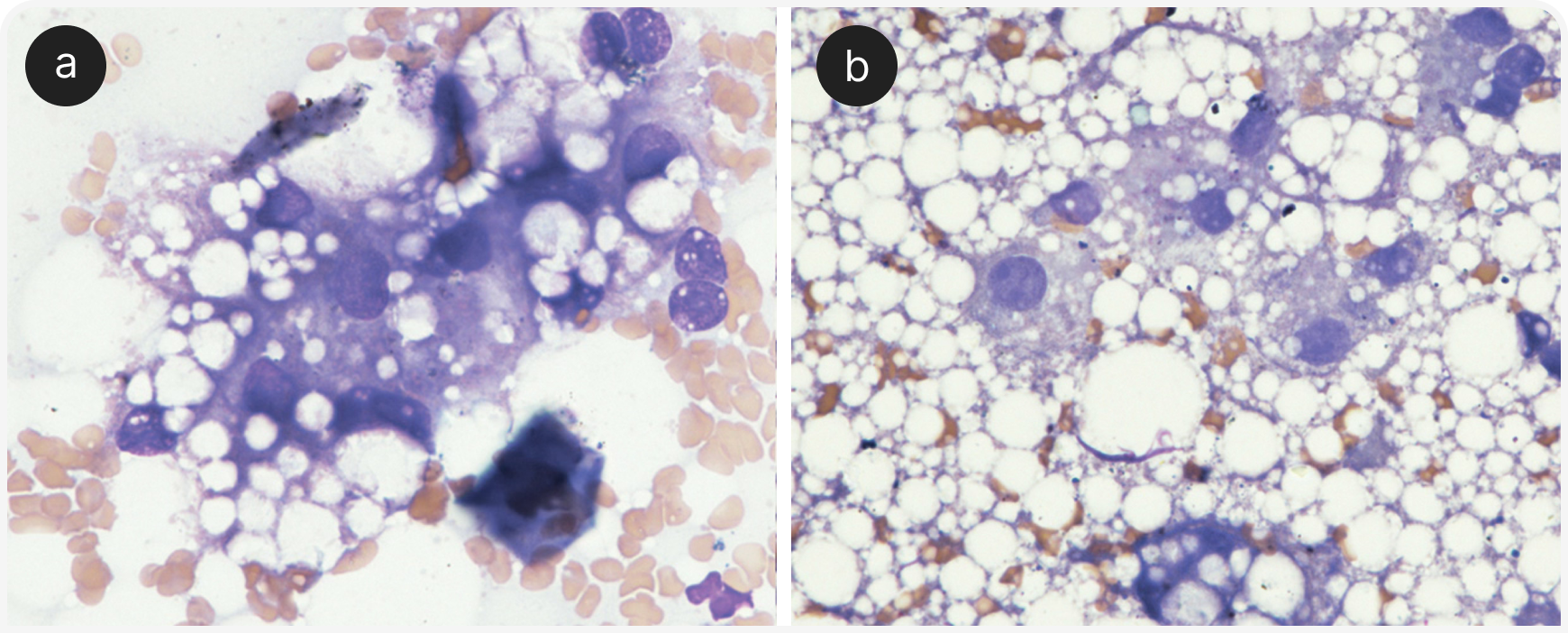
Окончательный диагноз ЛПК часто удается установить с помощью тонкоигольной аспирации ткани печени под контролем ультразвукового исследования (fine-needle aspiration — FNA) (17), обычно с использованием длинной иглы калибра 22/23G для подкожных инъекций или спинальной пункции. Липидные вакуоли выглядят как четко очерченные прозрачные пузырьки внутри цитозоля, чем отличаются от имеющих неправильную форму перистых заполненных гликогеном вакуолей гепатоцитов (Рисунок 2).
Различить их помогают специальные красители, но применять их приходится редко. Для диагностики ЛПК часто достаточно выявить в цитологических образцах в цитозоле гепатоцитов микровезикулярные и макровезикулярные отчетливо выраженные вакуоли. Частота развития серьезных осложнений (в первую очередь кровотечений) при FNA ниже, чем при биопсии печени.
В редких случаях при FNA выявляют первичные или сопутствующие заболевания печени, но данные FNA и биопсии печени коррелируют слабо (18, 19), а оценивать воспалительную инфильтрацию ткани печени при цитологическом исследовании затруднительно из‑за примеси крови. Кроме того, инфекционные заболевания печени при цитологическом исследовании образцов FNA диагностируют редко, однако легко можно выявить опухолевую инфильтрацию, особенно круглоклеточной опухолью. Таким образом, методу FNA печени свойствен ряд ограничений, и при определенных обстоятельствах можно рассмотреть проведение дополнительных диагностических вмешательств.
Помимо того, что ультразвуковое исследование брюшной полости полезно при отборе образцов для FNA, оно также помогает исключать сопутствующие или провоцирующие ЛПК заболевания (17). В целом ультразвуковое исследование печени неспецифично и низкочувствительно для диагностики (20); изменения эхогенности паренхимы могут быть обусловлены множеством очень разных заболеваний, и в то же время объемные и узелковые образования в печени легко не заметить.
При ЛПК обычно фиксируют гепатомегалию и повышение эхогенности ткани печени (по сравнению с жировой тканью серповидной связки), ухудшающие визуализацию стенки внутрипеченочной части воротной вены. Однако такие изменения могут также быть вызваны альтернативными или сопутствующими заболеваниями (например, инфильтративными) (20).
Первоначальное диагностическое обследование при ЛПК включает развернутый анализ крови, биохимический анализ, измерение ПВ/АЧТВ и ультразвуковое исследование органов брюшной полости с FNA печени. Эти исследования позволяют получить надежный минимальный набор данных для диагностики ЛПК, его осложнений и многих первичных или сопутствующих заболеваний. Нередко диагностический поиск на этой стадии приостанавливают и назначают первоначальное лечение.
При необходимости можно провести дополнительные исследования непосредственно для уточнения диагноза ЛПК, включая измерение в крови концентрации мочевины и витамина В12 (кобаламина). Первое исследование показано кошкам, находящимся в сильно угнетенном состоянии или имеющим неврологические нарушения, а второе — во всех случаях ЛПК, поскольку при анорексии запасы витамина В12 в организме кошек быстро истощаются.
При подозрении на сопутствующую бактериальную инфекцию желчевыводящих путей можно провести цистоцентез желчного пузыря для цитологического и бактериологического исследования жидкости. Это вмешательство считают безопасным, имеющим минимальный риск перфорации / утечки желчи или развития вагальной гипотонии (21). Наконец, если после нескольких недель лечения лабораторных и клинических улучшений не наблюдается, можно рассмотреть проведение биопсии печени, чтобы исключить другие заболевания.
Отличительной чертой ЛПК считают недостаточность питания. Независимо от провоцирующей причины и от того, была она устранена или нет, после развития ЛП появляется тошнота и возникает порочный круг анорексии и накопления липидов в печени. Основные компоненты лечения — нутритивная поддержка и купирование тошноты. ЛПК часто осложняется вторичным окислительным повреждением, воспалением и внутрипеченочным холестазом, поэтому дополнительно назначают препараты, способствующие утилизации жира, желчеобразованию и антиоксидантному действию.
Лечебное питание
Лечебное питание должно учитывать несколько факторов:
1. Энергические потребности организма.
На ранних сроках госпитализации кошек по поводу ЛПК потребление пищи обычно недостаточное, но принудительное кормление может вызвать отвращение к пище и замедлить возобновление самостоятельного питания. Поскольку восстановление может занять несколько недель, а также для облегчения дачи лекарств при лечении ЛПК часто используют зондовое кормление. Нутритивную поддержку следует начинать как можно раньше, но ее могут отсрочить значительное обезвоживание, электролитные нарушения, острое повреждение почек, артериальная гипотония, тяжелый неврологический дефицит.
В первые дни госпитализации, пока состояние кошки не станет достаточно стабильным для проведения общей анестезии, можно проводить частичное парентеральное питание (Partial Parenteral Nutrition — PPN). В отличие от полного, при частичном парентеральном питании не требуется обеспечивать доступ к центральной вене и реже развиваются осложнения. Если специализированные готовые растворы для PPN недоступны, можно ограничиться введением растворов аминокислот с постоянной скоростью.
После стабилизации состояния кошке можно под общим наркозом установить зонд для искусственного кормления. Методом выбора часто считают пищеводные зонды: их легко вставлять и использовать; можно вводить как жидкие, так и смешанные пищу и лекарства; они реже вызывают серьезные осложнения (кроме смещения или инфекции в области стомы), лечение легко проводить владельцам; кормление можно начинать вскоре после восстановления после анестезии; непреднамеренное преждевременное извлечение зонда не вызывает осложнений (22) (Блок 1).
До появления возможности проведения более длительной общей анестезии можно использовать назоэзофагеальные и назогастральные зонды, но их невозможно применять длительно: через них можно вводить только жидкости, и они причиняют кошке значительный дискомфорт. Наконец, в редких случаях показана чрескожная эндоскопическая установка зонда для кормления, за исключением случаев с невозможностью вводить корм в пищевод при его заболеваниях.
Обычно для удовлетворения потребностей кошки в незаменимых АК и жирах достаточно имеющихся в продаже высококалорийных богатых белками кормов, предназначенных для периода восстановления.
Ограничение потребления белка показано редко, если только не наблюдается тяжелая форма ПЭ. Расчетная суточная норма калорий (потребление энергии в покое: 30 × (масса тела) + 70 или (масса тела)0,75 × 70), даваемая в 4–6 приемов. Объем каждой порции, включая воду, используемую в конце кормления для промывания зонда, не должен превышать 10–15 мл/кг/порция. Объем и общую калорийность рекомендуется увеличивать постепенно, обычно в течение трех дней. Это необходимо для постепенной адаптации желудочно-кишечного тракта к пище, снижения риска развития кишечной непроходимости (которая может препятствовать дальнейшему кормлению) и рефидинг-синдрома (см. ниже раздел «Осложнения»).
При ЛПК в организме кошек истощаются запасы и жиро- (например, витамин D, витамин K), и водорастворимых (например, тиамин, кобаламин) витаминов (2). Их дефицит сопровождается множеством осложнений, включая коагулопатии, атрофию ворсинок кишечника, гипераммониемию, анемию, неврологические дефициты, поэтому прием витаминных добавок считают неотъемлемой частью лечения (Таблица 2).
Инфузионная терапия и лечение тошноты
При расчете суточной потребности в жидкости учитывают степень гидратации, базовые потребности, измеримые (например, со рвотой/диареей) и неизмеримые потери жидкости. Также необходимо учитывать риск сопутствующего заболевания сердца и объем энтеральной гидратации через зонд для кормления. При сопутствующей гипофосфатемии часто показаны добавки хлорида (KCl) или фосфата (KPO4) калия (Таблица 2). Если измерение концентрации магния в крови недоступно, можно провести консервативное вмешательство с добавлением в жидкость сульфата магния по 0,5 мэкв/кг каждые 24 часа в течение 2 дней.
Всем кошкам показана противосудорожная и противорвотная терапия метоклопрамидом, маропитантом и ондансетроном в различных комбинациях. Часто, особенно при анорексии, после выписки из стационара назначают миртазапин, обладающий противосудорожными и стимулирующими аппетит свойствами. Дополнительным преимуществом метоклопрамида является улучшение перистальтики желудочно-кишечного тракта. Если несмотря на лечение метоклопрамидом и устранение гипокалиемии развивается кишечная непроходимость, следует рассмотреть возможность лечения цизапридом (0,5 мг/кг внутрь каждые 8 часов).
Цитопротективная терапия
ЛПК может осложняться окислительным повреждением и снижением концентрации глутатиона, в таких случаях обычно назначают антиоксидантную терапию, в том числе SAMe и силимарином. SAMe — широко распространенная в организме и участвующая во множестве биохимических процессов молекула (23, 24), а силимарин (сочетание нескольких соединений, наиболее распространенное и активное — силибинин) оказывает противовоспалительное, желчегонное и антиоксидантное действие (23). Выпущен ряд ветеринарных препаратов с комбинацией силимарина и SAMe, но, если их применение внутрь или энтерально невозможно, для восполнения концентрации цистеина в печени и, следовательно, уровня глутатиона можно внутривенно вводить n-ацетилцистеин.
Однако он не обладает дополнительными преимуществами силимарина и SAMe, а при быстром введении может вызывать рвоту (23). Наконец, можно назначить витамин Е, поглотитель свободных радикалов, защищающий фосфолипиды клеточной мембраны от окисления; он обладает минимальными побочными эффектами, но о его клинических преимуществах также не сообщалось (23) (Таблица 2).
Другие препараты
Урсодезоксихолевая кислота — гидрофильная желчная кислота, обладающая желчегонными, антиапоптотическими, противовоспалительными свойствами и редко вызывающая побочные эффекты (23), поэтому может быть полезной при ЛПК (Таблица 2). L-карнитин переносит длинноцепочечные жирные кислоты в митохондрии, тем самым облегчая их использование для выработки энергии, а у кошек с ожирением на фоне снижения потребления пищи он уменьшает накопление триглицеридов в печени, причем его потенциальный положительный эффект при ЛПК был продемонстрирован в клинических наблюдениях (10). Хотя уровень карнитина у кошек с ЛПК повышен (25), его относительный дефицит все же возможен, поэтому рекомендуется его прием в виде добавок (Таблица 2).
При дефиците таурина развивается ряд заболеваний сердца, нервной и репродуктивной систем, а также нарушений развития, происходит накопление жира в печени. В коммерческих кормах содержится достаточное количество этой аминокислоты, но иногда рекомендуют энтеральное введение добавок, особенно при использовании урсодезоксихолевой кислоты, поскольку она усиливает потерю таурина с желчью (1). Наконец, при тяжелой ПЭ и гипераммониемии или при запорах можно рассмотреть назначение лактулозы, а при подозрении на язву желудка или рефлюкс-эзофагит — пантопразола/омепразола.
Патофизиология

Клинико-патологические данные
.png)
Диагностическое обследование
Лечение
2. Особые диетологические потребности кошек.
3. Обеспечение незаменимыми АК, необходимыми для правильного функционирования цикла мочевины, сборки липопротеинов и синтеза молекул антиоксидантов, таких как S-аденозилметионин (SAMe) и глутатион.
4. Обеспечение организма жирорастворимыми и водорастворимыми витаминами, недостаточность которых часто развивается при ЛПК.
5. Коррекция электролитного дисбаланса (часто внутривенными вливаниями, а некоторые электролиты также добавляют в корм).
.png)

Осложнения
ЛПК и его лечение могут сопровождаться множеством осложнений. Часто упоминают рефидинг-синдром (синдром возобновленного кормления) — совокупность метаболических изменений, развивающихся при возобновлении кормления после длительного недоедания, но у кошек он недостаточно документирован. Синдром сопровождается тяжелой гипофосфатемией, а иногда и гипокалиемией, гипомагниемией и дефицитом тиамина. Чтобы снизить риск его развития, потребление калорий увеличивают постепенно, с ограничением углеводов, преимущественным введением электролитов и тщательным наблюдением (1, 14, 15).
Диффузная атрофия ворсинок осложняет длительную анорексию, приводит к нарушению всасывания и диарее после возобновления энтерального питания. Снизить тяжесть диареи могут постепенное введение энтерального питания и использование легкоусвояемых кормов. При ЛПК у кошек часто развиваются сопутствующие заболевания, включая панкреатит, повреждение почек, кардиомиопатии, кровотечения / тромботические осложнения, инсулинорезистентность. Кроме того, на фоне гипоальбуминемии, заболеваний сердца или панкреатита может накапливаться выпот в полости тела, что свидетельствует о неблагоприятном прогнозе (9).
Наконец, недостаточность питания вызывает иммуносупрессию, которая предрасполагает к вторичным бактериальным инфекциям, и при подтвержденной инфекции (например, при холецистите) показано лечение антибиотиками. При определенных обстоятельствах антибактериальную терапию также можно рассмотреть на фоне тяжелой нейтропении/нейтрофилии и/или гипогликемии, даже если цитологических или бактериологических доказательств инфекции нет.
Липидоз печени — наиболее распространенное заболевание печени у кошек, с весьма вариабельным исходом, поскольку прогноз первичных и сопутствующих заболеваний различный. Общая выживаемость составляет 50–85%, неблагоприятными прогностическими симптомами в дебюте заболевания считают острый панкреатит, птиализм, выпот в полости тела, гипоальбуминемию и пожилой возраст. Липидоз печени сопровождается значительной частотой развития осложнений, требует интенсивного лечения и значительных расходов, но лечение часто оказывается успешным, а рецидивы встречаются редко. Заключение


телефона ниже для сброса пароля.



на номер
+7 {{ formatted_phone }}


Вы успешно прошли тест!
зарегистрироваться/авторизоваться
{{ formatted_phone }}.
Введите последние четыре цифры номера входящего звонка.

весь модуль
всех видеоуроков модуля














 200
200  10 мин
10 мин






