Введение
Сахарный диабет (СД) — распространенное заболевание пожилых кошек (1), и для его надлежащего лечения требуется тщательный мониторинг ответа на терапию инсулином. Хороший контроль гликемии во многих случаях приводит к ремиссии диабета (2–4). В последнее время стали доступны технологии, позволяющие непрерывно измерять уровень глюкозы в интерстициальной ткани, что значительно повысило возможности ветеринарного врача для контроля гликемии у животных с диабетом (5–9).
У кошек наиболее распространен СД 2-го типа; он характеризуется патологической секрецией инсулина поджелудочной железой в сочетании с резистентностью к инсулину периферических тканей. Заболевание диагностируют по клиническим проявлениям (полиурия, полидипсия, полифагия и потеря веса) и подтверждают выявлением гипергликемии и глюкозурии (2, 3). Диагностику у кошек осложняет стрессовая гипергликемия, поэтому важно не только зафиксировать стойкие гипергликемию и глюкозурию, но и исключить другие состояния, которые могут вызывать сходные клинические проявления, такие как гипертиреоз и желудочно-кишечные заболевания. Лечение сахарного диабета у кошек в основном включает инсулинотерапию, модификацию питания, терапию сопутствующих заболеваний, контроль веса. Во многих случаях диабета 2-го типа у кошек тщательный контроль гликемии инсулинотерапией позволяет достигать ремиссии. На вероятность ремиссии влияет ряд факторов, включая тяжесть поражения поджелудочной железы, наличие резистентности к инсулину вследствие сопутствующих заболеваний или приема лекарственных препаратов, ожирение, возможность перевести кошку на низкоуглеводную диету (10, 11). Прогрессирующая потеря бета-клеток может привести к прогрессированию заболевания с развитием СД 1-го типа, поэтому тщательный контроль гликемии имеет ключевое значение для положительного исхода.
Для первой линии терапии сахарного диабета у кошек применяют три препарата инсулина (Таблица 1): протамин-цинк-инсулин (protamine zinc insulin — PZI), инсулин Ленте (цинк-суспензия свиного инсулина) и инсулин гларгин, аналог инсулина (3). Можно также использовать детемир (другой аналог инсулина), но его не считают препаратом первой линии из‑за высокой стоимости. НПХ-инсулин (нейтральный протамин Хагедорна) у кошек, как правило, имеет очень короткое действие и не рекомендуется к применению.
Терапию впервые диагностированного диабета инсулином начинают с дозы 1–3 ЕД (0,25–0,5 ЕД/кг), и автор рекомендует нижний предел этой дозы. Какой бы препарат ни был выбран, контроль гликемии достигается с большей вероятностью при проведении инъекций дважды в день, а не один раз в день. Если первое невозможно, эффективно купировать клинические проявления у некоторых кошек позволяют однократные ежедневные инъекции PZI или гларгина.
Основная цель инсулинотерапии — купировать клинические проявления СД, избегая при этом гипогликемии. Дополнительной целью может быть достижение ремиссии диабета. В плане мониторинга учитывают образ жизни владельца, любые сопутствующие заболевания, возраст пациента, практическую целесообразность тщательного контроля уровня глюкозы. Вероятность ремиссии у кошек выше при более строгом контроле гликемии; однако тяжелая гипогликемия может привести к необратимым неврологическим нарушениям. Индуцированная инсулином гипогликемия также вызывает секрецию гормонов, противодействующих действию инсулина, таких как глюкагон, соматотропный гормон, кортизол и адреналин, которые могут вызывать резистентность к инсулину и ухудшать контроль диабета.
В идеале уровень глюкозы в крови следует поддерживать в пределах 80–200 мг/дл (4,4–11,1 ммоль/л), но у большинства кошек с диабетом ее уровень периодически повышается. Клинически для большинства кошек наиболее благоприятно поддержание концентрации глюкозы в крови в течение большей части дня на уровне ниже 300 мг/дл (16,7 ммоль/л), поскольку максимум канальцевой реабсорбции глюкозы в почках кошек составляет приблизительно 270 мг/дл (15 ммоль/л) (12). Важно помнить, что, если минимальный уровень глюкозы находится в гипогликемическом диапазоне, секретируются контррегуляторные гормоны, такие как глюкагон, что повышает уровень глюкозы в крови и затрудняет оценку истинной продолжительности действия инсулина. В идеале стратегию мониторинга для оценки реакции на лечение инсулином у кошек с диабетом следует подбирать для каждого пациента и владельца индивидуально.
До недавнего времени основными инструментами мониторинга, имевшимися в распоряжении ветеринарного врача, были оценка клинических проявлений и массы тела, а также последовательные измерения концентраций глюкозы в крови, глюкозы в моче и гликозилированных белков.
Наиболее важной целью лечения любой кошки, страдающей диабетом, является контроль клинических признаков заболевания. У кошек с неадекватным гликемическим контролем обычно наблюдаются стойкие проявления болезни и прогрессирующая потеря веса. Тяжелая гипогликемия может проявляться периодическими признаками, такими как слабость, вялость и судороги.
Легкую гипогликемию часто упускают, поскольку она не имеет явных клинических признаков, и это способствует плохому гликемическому контролю.
Много лет золотым стандартом оценки контроля гликемии у кошек считали традиционный мониторинг уровня глюкозы в крови в стационаре или на дому, но этому методу свойственно множество ограничений. Он дорогостоящий и требует получения множества образцов крови, что снижает качество жизни пациента и владельца. Кроме того, такие измерения уровня глюкозы в крови в различные дни весьма вариабельны, даже если их всегда выполняет владелец на дому (Рисунок 1) (13). Неправильная интерпретация результатов также может привести к некорректным назначениям.
Измерение уровня гликозилированных белков, таких как фруктозамин и гемоглобин A1C (HbA1c), позволяет оценить долгосрочный контроль гликемии и помогает в интерпретации результатов мониторинга уровня глюкозы в крови. Глюкоза необратимо связывается с белками сыворотки и гемоглобином, и они остаются в крови на весь срок жизни белка; их можно измерить, соответственно, в сыворотке или цельной крови. Фруктозамин показывает адекватность контроля гликемии в течение предыдущих 1–2 недель, а HbA1c отражает контроль гликемии в течение предыдущих 4–6 недель (14–16).
Измерение концентрации глюкозы в моче также помогает оценить контроль гликемии и особенно полезно у кошек, входящих в ремиссию, и для выявления рецидива диабета после ремиссии. Суточные дозы инсулина не следует подбирать по уровням глюкозы в моче, но динамика глюкозурии может быть очень полезной при оценке контроля диабета, особенно если измерять ее постоянно и вести дневник или журнал. Появление в моче кетонов также может указывать на риск развития диабетического кетоацидоза.
Системы непрерывного мониторинга глюкозы (continuous glucose monitoring — CGM) позволяют непрерывно оценивать интерстициальную концентрацию глюкозы в крови в течение периода до 14 дней с помощью небольшого гибкого катетера, помещаемого подкожно. Появление CGM в арсенале средств ветеринарного врача улучшило возможности точного мониторинга состояния кошек, получающих инсулин, и повысило чувствительность выявления гипогликемии по сравнению с традиционным способом измерения уровня глюкозы. Метод позволяет подбирать дозу инсулина в режиме реального времени и корректировать ее с учетом дневных и ночных потребностей организма.
В валидационных исследованиях у ветеринарных пациентов было показано, что концентрация глюкозы в интерстициальной жидкости в большинстве случаев хорошо коррелирует с концентрацией глюкозы в крови, а используемые в ветеринарной медицине современные системы CGM доступны по цене, просты во внедрении и эксплуатации, хорошо переносятся пациентами. Они позволяют проводить комплексный анализ изменений уровня глюкозы в интерстициальной жидкости на основании показаний за 14 дней. В настоящее время для измерения уровня глюкозы в интерстициальной жидкости чаще всего используют 14-дневный монитор Freestyle Libre™ (FSL) (Рисунок 2), валидированный для применения у кошек. У кошек также использовали модели Freestyle Libre™ 2 и 3, но их точность в рецензируемой литературе еще не описана.
На рынке представлены и другие системы непрерывного мониторинга уровня глюкозы, включая Dexcom-CGM™ и Eversense CGM™, но, опять же, эти системы еще не протестированы на кошках.
Важнейшими показаниями к применению FSL в настоящее время считают диабетический кетоацидоз, недавно диагностированный СД и нестабильное течение СД, при котором систему применяют непрерывно до достижения контроля гликемии. Также она очень полезна для рутинного периодического мониторинга у стабильных пациентов.
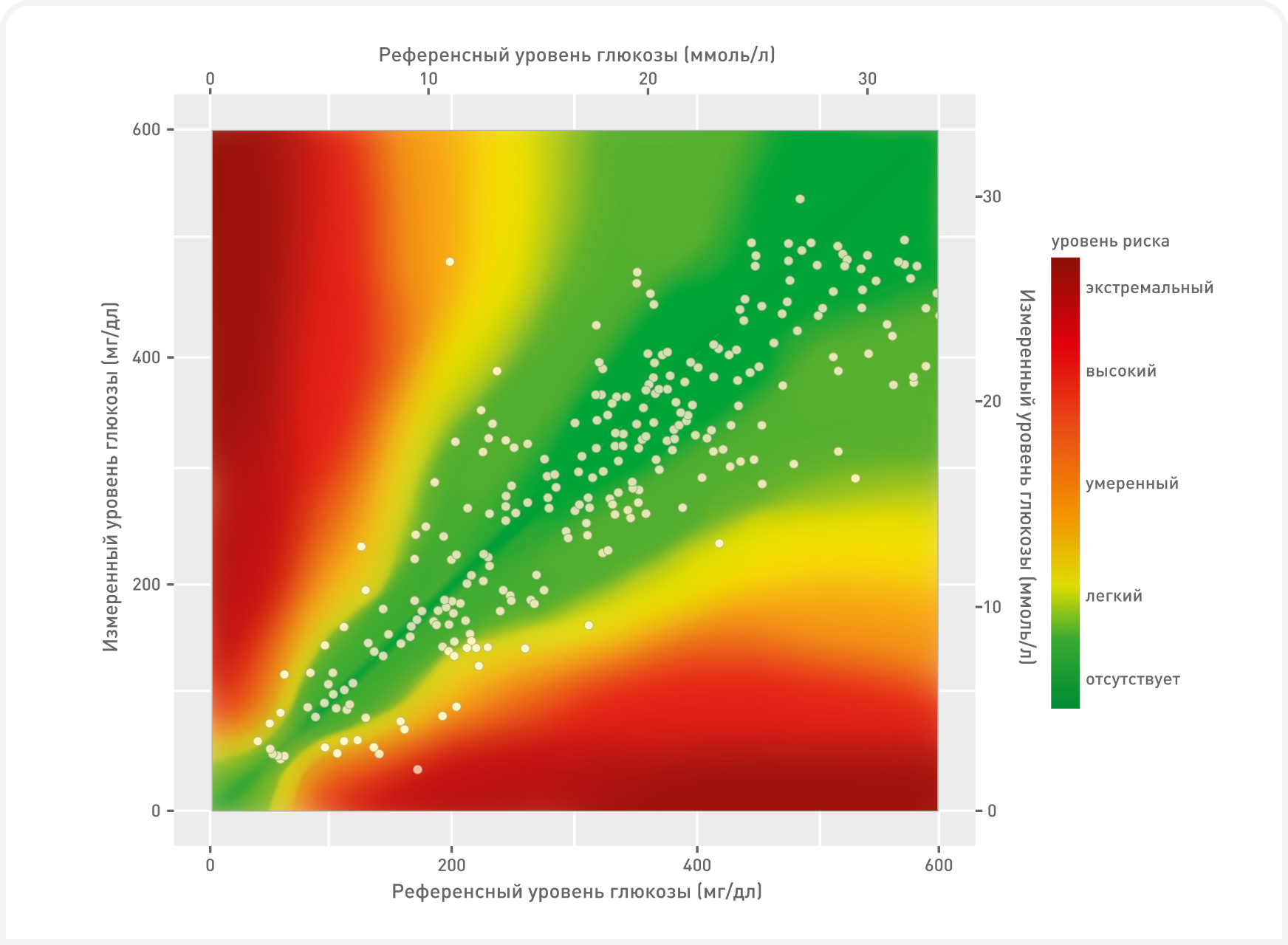
Точность 14-дневного монитора FSL у кошек была оценена в нескольких исследованиях (5–8). Было показано, что измеренный датчиком уровень глюкозы в интерстициальной жидкости хорошо коррелирует с уровнем глюкозы в периферической крови при измерении глюкометром в клинике или автоматическим биохимическим анализатором в лаборатории. В большинстве исследований было отмечено, что FSL немного занижает уровень глюкозы в крови по сравнению с фактическим значением, но анализ сетки ошибок наблюдения позволяет достичь достаточной клинической точности измерения (Рисунок 3) (5).
Важно знать, что между изменениями уровня глюкозы в интерстициальной жидкости и в крови существует лаг в 30 минут, поэтому результаты измерений могут несколько различаться (8); разница между этими показателями наиболее заметна при быстром изменении уровней глюкозы в крови. В большинстве исследований корреляция между уровнем глюкозы в крови и глюкозой в интерстициальной жидкости была более слабой при гипогликемическом диапазоне, но это могло быть связано с меньшим количеством гипогликемических образцов в опубликованных исследованиях, а также с влиянием быстрых изменений уровня глюкозы в крови.
Оценка датчика Libre 2 на сегодняшний день опубликована только в виде отдельной краткой публикации (17), в которой отмечается, что датчик слегка занижает уровень гликемии в умеренно гипогликемическом и эугликемическом диапазонах и в то же время завышает при очень низких концентрациях глюкозы (< 49 мг/дл, т.е. 2,7 ммоль/л).
В целом исследования показывают, что у большинства кошек с диабетом разница уровней глюкозы в интерстициальной жидкости и крови практически не влияет на принятие клинических решений и что FSL достаточно точен для мониторинга гликемии у кошек. Исследований применения монитора при диабетическом кетоацидозе (ДКА) у кошек не проводилось, но, по опыту клиники автора, он очень полезен в такой ситуации. Было показано, что у собак при кетозе его эффективность не снижается, однако у животных с дегидратацией точность измерений уменьшается (18, 19). При использовании монитора у собак также было показано, что на точность измерений влияет толщина кожи (20), но у кошек это влияние не оценивалось.
14-дневный датчик FSL — одноразовое устройство диаметром 35 мм и толщиной 5 мм (Рисунок 4), устанавливаемое на кожу и позволяющее в режиме реального времени измерять уровни глюкозы в интерстициальной жидкости, проводя по датчику сканером. Можно приобрести специальный считыватель и использовать его многократно с несколькими датчиками, что выгодно для условий стационара, или сканировать датчик бесплатным приложением, совместимым с большинством смартфонов Android или iPhone.
В любом из вариантов данные можно загрузить на компьютер или на веб-сайт LibreView с помощью бесплатного программного обеспечения. Для датчика Freestyle Libre™ считыватель и приложение можно использовать вместе, особенно если считыватель используется для начальной настройки датчика. Обратите внимание, что это не относится к датчику Libre 2, где устройство чтения и приложение для телефона не могут использоваться взаимозаменяемо. Для приобретения датчика и считывателя в розничной аптеке США требуется рецепт, в большинстве других стран рецепт не потребуется.
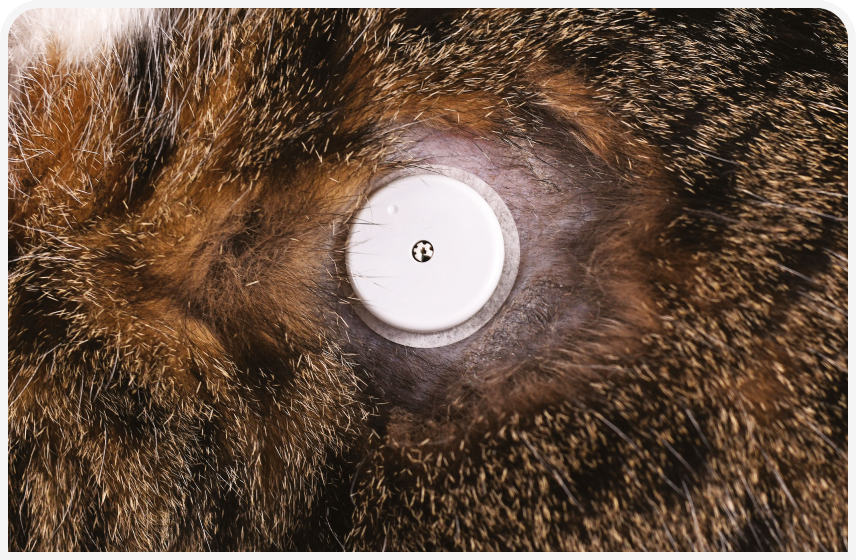
Для установки датчика участок кожи (приблизительно 5×5 см), немного превышающий размер датчика, выбривают и очищают спиртовым тампоном. Упаковку с датчиком загружают в аппликатор (Рисунок 5) и на нижнюю сторону диска по часовой стрелке наносят 4–8 капель тканевого клея. Затем аппликатор разворачивают под прямым углом к поверхности кожи, избегая области костных выступов. После установки датчика игла входит под кожу, и зонд попадает в интерстициальное пространство; диск оставляют приклеенным к поверхности кожи. Затем датчик запускают с помощью считывателя или смартфона, и через 60 минут он готов к использованию.
Датчик можно расположить на различных участках тела, лучше всего — на дорсо-латеральной поверхности грудной клетки или между лопатками (Рисунок 6). Важно избегать какого‑либо контакта с ошейником или шлейкой, которые могут оказывать давление на датчик. Перейдя по ссылке, можно посмотреть видео о правильном размещении датчика.
В зависимости от пациента датчик можно оставить непокрытым либо защитить клейким пластырем, попоной, специальной одеждой для домашних животных или чем‑то подобным (Рисунок 7). Такое защитное покрытие необходимо активным пациентам или живущим вместе с другими животными, которые могут попытаться сорвать датчик; данные со считывателя можно получать, не снимая покрытие. Хотя датчик водонепроницаемый, купать животное или позволять ему плавать, пока датчик установлен, не рекомендуется. После истечения срока годности датчик удаляют, аккуратно сняв с кожи. Если необходимо удалить клей, кожу обрабатывают спиртом или маслом для кожи (детским).
В зависимости от пациента датчик можно оставить непокрытым либо защитить клейким пластырем, попоной, специальной одеждой для домашних животных или чем‑то подобным (Рисунок 7). Такое защитное покрытие необходимо активным пациентам или живущим вместе с другими животными, которые могут попытаться сорвать датчик; данные со считывателя можно получать, не снимая покрытие. Хотя датчик водонепроницаемый, купать животное или позволять ему плавать, пока датчик установлен, не рекомендуется. После истечения срока годности датчик удаляют, аккуратно сняв с кожи. Если необходимо удалить клей, кожу обрабатывают спиртом или маслом для кожи (детским).
В течение 14 дней FSL ежеминутно измеряет уровень глюкозы в интерстициальной жидкости и каждые 15 минут сохраняет эти данные на диске датчика. Данные на диске могут сохраняться до 8 часов и при каждом сканировании датчика загружаются на считыватель или мобильный телефон. Датчик можно сканировать в любой момент, но для непрерывности мониторинга не следует делать это реже чем каждые 8 часов, иначе часть данных будет заменена новыми. Затем данные можно загрузить в компьютер или на сайт LibreView и просмотреть в режиме онлайн или в виде pdf-файла. Веб-сайт LibreView позволяет хранить в облаке данные от нескольких пациентов, к ним могут получить доступ как владелец, так и сотрудники ветеринарной клиники. Бесплатное программное обеспечение генерирует сводный отчет, который можно просмотреть онлайн или загрузить в формате pdf.
Хотя в целом уровни глюкозы в крови и интерстициальной жидкости хорошо коррелируют, при использовании датчика могут возникнуть проблемы. К ним относятся сообщения об ошибках, задержки с передачей измеренного уровня глюкозы, не совпадающие с клинической картиной устойчиво высокие или низкие показатели, пробелы в данных, резкие колебания уровня глюкозы в интерстициальной жидкости (Рисунок 8).
Иногда датчик отказывает полностью. Еще одна небольшая сложность: устройство измеряет концентрацию глюкозы в диапазоне от 40 до 500 мг/дл, но генерируемые в отчетах графики не показывают концентрацию глюкозы выше 350 мг/дл (19,4 ммоль/л). При любых сомнениях в точности показаний следует измерить уровень глюкозы в крови либо сертифицированным глюкометром, либо автоматическим биохимическим анализатором. Осложнения у пациента могут включать эритему и (редко) образование абсцесса в месте установки датчика; поэтому, если предполагается длительный мониторинг, последующие датчики следует устанавливать на разных участках тела. Обратите также внимание, что, хотя FSL позволяет измерять уровень глюкозы в интерстициальной жидкости на протяжении 14 дней, во многих случаях датчик самопроизвольно отделяется от кожи раньше; у кошек средний срок службы датчика составляет приблизительно 8 дней.
Инсулинотерапия
Типы инсулина

Цели лечения инсулином
Традиционные способы мониторинга при диабете
Клинические проявления
Графики уровня глюкозы в крови

Гликозилированные белки
Глюкоза в моче
Непрерывный мониторинг уровня глюкозы

Точность монитора FSL
Использование монитора FSL

.png)
Осложнения CGM

Интерпретация данных
Сводный отчет FSL, который можно просмотреть на веб-сайте производителя или с помощью бесплатного загружаемого на компьютер программного обеспечения, отображает данные в нескольких вариантах. В ежедневном журнале и еженедельной сводке показаны графики за отдельные дни, а в обзоре показателей глюкозы и амбулаторном отчете об уровне глюкозы отображены усредненные по времени данные. Это позволяет оценивать как ежедневную изменчивость, так и недельные тенденции изменения гликемии. Отчеты позволяют ветеринарному врачу оценить дозу и кратность введения инсулина, а также определить различия потребности в инсулине в течение дня по сравнению с ночной дозой. Также можно точно оценить степень контроля гликемии у кошек, получающих инсулин один раз в день. Другое важное преимущество — возможность отслеживать ежедневные изменения реакции на инсулин и определять частоту возникновения гипо- и гипергликемии.
Графики интерпретируют аналогично традиционному графику уровня глюкозы в крови, но они дают возможность лучше оценить ежедневную изменчивость гликемии. Можно легко определить минимальный уровень глюкозы в крови, продолжительность действия инсулина и средний уровень глюкозы. В идеале уровень глюкозы должен составлять минимально 80–150 мг/дл (4,4–8,3 ммоль/л), а в течение большей части дня ниже 300 мг/дл (16,6 ммоль/л). По отчетам FSL можно выявить неадекватную дозу инсулина, недостаточную продолжительность действия инсулина (быструю метаболизацию), индуцированную инсулином гипогликемию (Рисунок 9), отсутствие реакции на инсулин; последнее может быть вызвано несоблюдением режима введения либо резистентностью к инсулину.
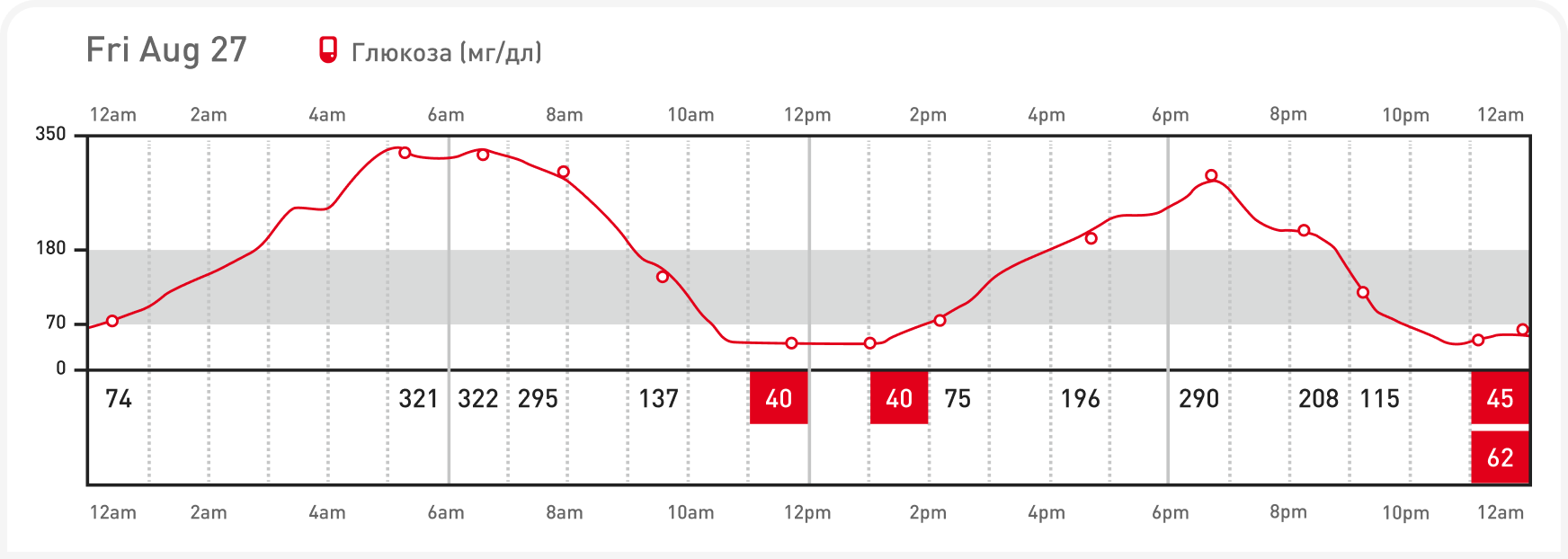
На основе полученного графика при необходимости можно изменить дозу инсулина или сменить препарат и оценить реакцию, в то время когда датчик еще на месте. Поскольку измерения глюкозы доступны в режиме реального времени, также можно быстро обнаружить клинически значимую гипогликемию и немедленно начать ее терапию, а дозу инсулина снизить. При использовании FSL для корректировки дозы инсулина между изменениями дозы важно выждать 5–7 дней, а поскольку срок службы датчика составляет 14 дней, обычно можно успеть изменить дозу дважды; конечно, при необходимости дозу можно уменьшать и чаще.
Как уже упоминалось, хотя корреляция данных между FSL и традиционными глюкометрами обычно хорошая, возможны и действительно происходят сбои датчика или ошибки измерения. Если данные измерения уровня глюкозы в крови не соответствуют клинической картине, следует оценить уровень глюкозы в крови глюкометром или другим надежным методом. Неисправный датчик может вызывать сообщения об ошибке, сообщения о необходимости повторно просканировать датчик позже, пробелы в данных, неожиданно значительные и не соответствующие клиническим проявлениям колебания уровня глюкозы в крови. В таких ситуациях, если результаты измерения с помощью FSL не коррелируют с данными измерения глюкометром, датчик следует заменить.
Заключение
Таким образом, устройства непрерывного мониторинга глюкозы могут быть очень ценными при контроле гликемии у кошек, а хорошее понимание технологии измерения выбранного датчика (также как его ограничений и потенциальных ошибок) позволяет максимально эффективно использовать эту методику. Эти устройства помогают клиницистам проводить более точный мониторинг пациентов с диабетом и таким образом повышают вероятность достижения диабетической ремиссии. При необходимости их можно использовать в большинстве клиник первичного звена.
-
1.O’Neill DG, Gostelow R, Orme C, et al. Epidemiology of diabetes mellitus among 193,435 cats attending primary-care veterinary practices in England. J. Vet. Int. Med. 2016;30:964-972.
-
2.Behrend E, Lathan P, Rucinksy R, et al. 2018 AHHA Diabetes management guidelines for dogs and cats. J. Am. Anim. Hosp. Assoc. 2018;54:1-21.
-
3.Sparkes AH, Cannon M, Church D, et al. ISFM consensus guidelines on the practical management of diabetes mellitus in cats. J. Feline Med. Surg. 2015;17:235-250.
-
4.Roomp K, Rand J. Intensive blood glucose control is safe and effective in diabetic cats using home monitoring and treatment with Glargine. J. Feline Med. Surg. 2009;11:668-682.
-
5.Knies M, Teske E, Kooistra H. Evaluation of the FreeStyle Libre™ , a flash glucose monitoring system, in client-owned cats with diabetes mellitus. J. Feline Med. Surg. 2022;24(8):e223-e231. DOI: 10.1177 /1098612X221104051. Epub 2022 Jun 28.
-
6.Deiting V, Mischke R. Use of the Freestyle Libre™ glucose monitoring system in diabetic cats. Res. Vet. Sci. 2021;135:253-259.
-
7.Shea EK, Hess RS. Validation of a flash glucose monitoring system in outpatient diabetic cats. J. Vet. Intern. Med. 2021;35:1703-1712.
-
8.Del Baldo F, Fracassi F, Pires J, et al. Accuracy of a flash glucose monitoring system in cats and determination of the time lag between blood glucose and interstitial glucose concentrations. J. Vet. Intern. Med. 2021;35:1279-1287.
-
9.Shoelson AM, Mahoney OM, Pavlick M. Complications associated with a flash glucose monitoring system in diabetic cats. J. Feline Med. Surg. 2021;23(6):557-562.
-
10.Clark M, Hoenig. M. Feline comorbidities: Pathophysiology and man-agement of the obese diabetic cat. J. Feline Med. Surg. 2021;23(7);639-648.
-
11.Gostelow R, Forcada Y, Graves T, et al. Systematic review of feline diabetic remission: Separating fact from opinion. Vet. J. 2014;202:208-221.
-
12.Zeugswetter FK, Polsterer T, Krempl H, et al. Basal glucosuria in cats. J. Anim. Physiol. Anim. Nutr. (Berl.). 2019;103(1):324-330. DOI: 10.1111/jpn.13018. Epub 2018 Oct 29.
-
13.Alt N, Kley S, Haessig M, et al. Day-to-day variability of blood glucose concentration curves generated at home in cats with diabetes mellitus. J. Am. Vet. Med. Assoc. 2007;230(7):1011-1017. DOI: 10.2460/javma.230.7.1011.
-
14.Link KR, Rand JS. Changes in blood glucose concentration are associated with relatively rapid changes in circulating fructosamine concentrations in cats. J. Feline Med. Surg. 2008;10:583-592.
-
15.Norris O, Schermerhorn T. Relationship between HbA1c, fructosamine and clinical assessment of glycemic control in dogs. PLoS One. 2022;17(2):e0264275. DOI: 10.1371/journal.pone.0264275. eCollection 2022.
-
16.Hoening M, Ferguson DC. Diagnostic utility of glycosylated hemoglobin concentrations in the cat. Dom. Anim. Endocrin. 1999;16(1);11-17.
-
17.Berg AS, Crews CD, Alfonso-Castro C, et al. Assessment of the FreeStyle Libre™ 2 interstitial glucose monitor in hypo- and euglycemia in cats. Abstract EN05 (2022), ACVIM Forum Research Abstract Program. J. Vet. Intern. Med. 2022;36:2282-2454. https://doi.org/10.1111/jvim.16541
-
18.Silva DD, Cecci GRM, Biz G, et al. Evaluation of a flash glucose monitoring system in dogs with diabetic ketoacidosis. Dom. Anim. Endocrin. 2021;74:106525. DOI: 10.1016/j.domaniend.2020.106525. Epub 2020 Jul 18.
-
19.Malerba E, Cattani C, Del Baldo F, et al. Accuracy of a flash glucose monitoring system in dogs with diabetic ketoacidosis. J. Vet. Intern. Med. 2020;34:83-91.
-
20.Del Baldo F, Diana A, Canton C, et al. The influence of skin thickness on flash glucose monitoring system accuracy in dogs with diabetes mellitus. Animals (Basel) 2021;11(2):408. DOI: 10.3390/ani11020408.




 1269
1269  10 мин
10 мин








